题目内容
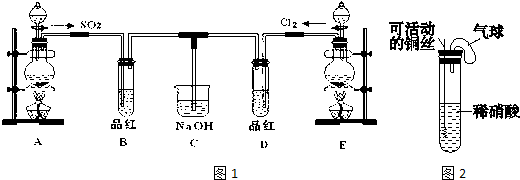
6.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 一定条件下,5.2g乙炔和苯的混合气体中含有的碳原子数为0.4NA | |
| B. | 标准状况下,2.24L氖气所含原子数为0.2NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数2 NA | |
| D. | 5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
分析 A.乙炔和苯的最简式都是CH,根据最简式计算出混合物中含有碳原子的物质的量及数目;
B.稀有气体为单原子分子,0.1mol氖气分子中含有0.1mol原子;
C.硫酸氢钠固体中含有的阳离子为钠离子,1mol硫酸氢钠固体中含有1mol阳离子;
D.铁与水蒸气反应生成四氧化三铁,产物中铁元素的化合价为+$\frac{8}{3}$价.
解答 解:A.5.2g乙炔和苯的混合气体中含有含有5.2g最简式CH,含有CH的物质的量为:$\frac{5.2g}{13g/mol}$=0.4mol,所以该混合物中含有0.4mol碳原子,含有的碳原子数为0.4NA,故A正确;
B.标准状况下,2.24L氖气的物质的量为1mol,1mol氨气分子中含有1mol氖原子,所含原子数为0.1NA,故B错误;
C.1mol硫酸氢钠固体中含有1mol钠离子和1mol硫酸氢根离子,所以含有1mol阳离子,含阳离子总数NA,故C错误;
D.5.6g铁的物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,铁与水蒸气反应生成四氧化三铁,转移电子的物质的量为:0.1mol×$\frac{8}{3}$=$\frac{4}{15}$mol,转移电子的数目为$\frac{4}{15}$NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B为易错点,注意稀有气体为单原子分子.

练习册系列答案
相关题目
17.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原.现用25.00mL 0.04mol/L的羟胺的酸性溶液跟30.00mL 0.02mol/L的KMnO4酸性溶液完全作用.已知MnO4-→Mn2+则在上述反应中,羟胺的氧化产物是( )
| A. | NO | B. | N2O | C. | N2 | D. | NO2 |
1.对下列由电极和电解质溶液构成的装置叙述不正确的是( )
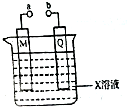

| A. | 若X、M、Q分别是H2SO4、Pb和PbO2,a、b连接后两极都有PbSO4生成 | |
| B. | 若X、M、Q分别是滴加酚酞的Na2SO4、C和Fe,a、b分别连接电源的正、负极,则通电后Q周围溶液颜色变红 | |
| C. | 若X、M、Q分别CuSO4、Cu和Fe,a、b分别连接电源的正、,则可在铁上镀铜 | |
| D. | 若X、M、Q分别是NaCl、C和Fe,则a、b连接后,M电极上有气体产生 |
11. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成Cu而使Cu2O产率降低.
(2)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O
(3)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g)$\frac{\underline{\;\;\;光\;\;\;}}{Cu_{2}O}$2H2(g)+O2(g)△H>0
水蒸气的浓度(mol•L-1)随时间t (min)变化如下表:
可以判断:实验①的前20 min的平均反应速率 ν(O2)=3.5×10-5mol/(L.min);;实验温度T1<T2(填“>”“<”);催化剂的催化效率:实验①<实验②(填“>”、“<”).
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O
(3)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g)$\frac{\underline{\;\;\;光\;\;\;}}{Cu_{2}O}$2H2(g)+O2(g)△H>0
水蒸气的浓度(mol•L-1)随时间t (min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
13.某研究性学习小组向一定量的NaHSO4溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.为进一步研究有关因素对反应速率的影响,探究如下.
通过测定溶液变蓝所用时间来探究外界-条什对该反应速率的影响,记录如下:
实验①②是探究KIO3溶液的浓度对反应速率的影响,表中t1>t2(填“>”、“=”或“<”);实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.
通过测定溶液变蓝所用时间来探究外界-条什对该反应速率的影响,记录如下:
| 编号 | 0.01mol/LNaHSO3溶液(mL) | 0.01mol/LKIO3溶液(mL) | H2O(mL) | 反应温度(℃) | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
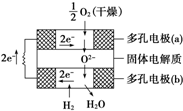 2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.
2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.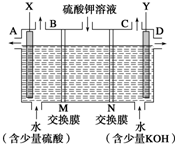 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.