题目内容
5.“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(1)═C2H4(g)+3O2(g).△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol.
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率:增大(填“增大”“减小”“不变”).
②该反应的正反应为放(填“吸”或“放”)热反应.
(3)一定条件下,将3molH2和lmolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g). 2min末该反应达到平衡,测得
CH3OH的浓度为0.2mol/L.下列判断不正确的是bcd
a.该条件下此反应的化学平衡常数表达式为k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$
b.H2的平均反应速率为0.3mol/(L•s)
c.CO2的转化率为60%
d.混合气体的密度不再改变时,该反应一定达到平衡状态
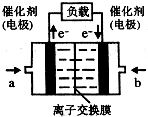
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是乙醇(填“乙醇”或“氧气”),b处电极上发生的电极反应是:O2+4e-+2H2O=4OH-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于1.4×10-5mol/L.
分析 (1)利用盖斯定律可以计算反应的焓变;
(2)增加氢气的量能够使二氧化碳的转化率增大;升高温度化学平衡向着吸热方向进行;
(3)a、化学平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$(固体和纯溶剂不列入表达式中);
b、化学反应速率等于单位时间内物质的浓度的变化量;
c、物质的转化率=$\frac{变化量}{起始量}$×100%,
d、混合气体的密度=$\frac{混合气体质量}{体积}$,看分子和分母的变化来判断是否为平衡状态;
(4)失电子的极为负极,燃料电池中燃料作负极,氧气在正极上放电;
(5)根据沉淀的溶度积表达式Ksp=[Ca2+][CO32-]来进行计算.
解答 解:(1)根据盖斯定律,乙烯水化制乙醇的反应应是2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
和2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol的差,故C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol,
故答案为:C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol;
(2)①温度一定时,提高氢碳比[n(H2)/n(CO2)],相当于增加氢气的量,增加氢气的量能够使二氧化碳的转化率增大,故答案为:增大;
②从表中数据看出:温度越高,二氧化碳的转化率越小,升高温度化学平衡向着吸热方向,即向着使二氧化碳的转化率减小的方向(逆向)进行,故正向是放热反应,故答案为:放;
(3)a、化学平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$(固体和纯溶剂不列入表达式),K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{{c}^{3}({H}_{2})c(C{O}_{2})}$,故a正确;
b、H2的平均反应速率=$\frac{△c({H}_{2})}{△t}$=0.3mol/(l•min),而不是3mol/(l•s),选项单位错误,故b错误;
c、甲醇的浓度为0.2mol/L,生成的物质的量为0.4mol,则消耗掉的二氧化碳为0.4mol,所以二氧化碳物质的转化率=$\frac{变化量}{起始量}$×100%=$\frac{0.4mol}{1mol}$×100%=40%,故c错误;
d、混合气体的密度=$\frac{混合气体质量}{体积}$,混合气体的质量遵循质量守恒,任何状态下质量均是定值,此反应又是在固定容积为2L的密闭容器中发生,所以体积在任何状态下均是定值,所以密度在任何状态下均是定值,故d错误,故答案为:bcd;
(4)根据乙醇燃料电池的结构示意图可以看出a极为失去电子的极,失电子的极为负极,在燃料电池中燃料作负极,氧气在正极上放电,
故答案为:乙醇;O2+4e-+2H2O=4OH-;
(5)根据碳酸钙沉淀的溶度积表达式Ksp=[Ca2+][CO32-],若Na2CO3溶液的浓度为2×10-4mol/L,则混合溶液中生成沉淀所需Ca2+的最小浓度c=$\frac{Ksp}{c(C{{O}_{3}}^{2-})}$=$\frac{2.8×1{0}^{-5}}{2×1{0}^{-4}}$=1.4×10-5mol/L,
故答案为:1.4×10-5mol/L.
点评 本题考查了学生对电化学和化学平衡知识的掌握,主要是热化学方程式书写、化学平衡影响因素、反应速率的计算分析、原电池原理和溶度积常数计算,要求学生具有分析和解决问题的能力,难度中等.

 智慧小复习系列答案
智慧小复习系列答案| A. | NO | B. | N2O | C. | N2 | D. | NO2 |
| A. | A与B一定都是气体 | B. | 平衡向正反应方向移动了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b |
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
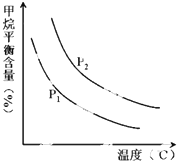
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
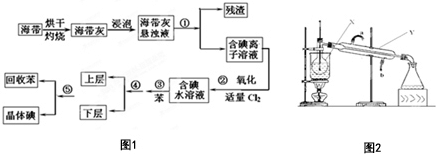 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海带中提取碘的流程图如图1:(已知:Cl2+2I-═2Cl-+I2)
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海带中提取碘的流程图如图1:(已知:Cl2+2I-═2Cl-+I2) 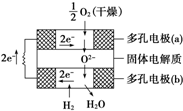 2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.
2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.