题目内容
8.某中学化学兴趣小组想使用如图装置制取较多量的饱和氯水和漂白粉等实验.回答下列问题.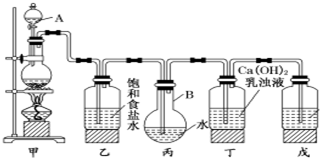
(1)写出仪器的名称:A分液漏斗,B圆底烧瓶.
(2)写出甲、丁装置中发生反应的化学方程式:
甲:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
丁:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
(3)装置乙的作用是除去HCl气体.
(4)装置戊中所装的试剂是NaOH.(填化学式)
分析 (1)熟悉仪器的形状说出其名称;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
(3)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯化氢、氯气在饱和食盐水中溶解度性质选择除杂剂;
(4)氯气有毒,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收.
解答 解:(1)图中仪器A为分液漏斗,B为圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓) $\frac{\underline{\;加热\;}}{\;}$ MnCl2+Cl2↑+2H2O;
氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,化学方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;加热\;}}{\;}$ MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用盛有饱和氯化钠溶液的乙除去氯化氢气体,
故答案为:除去HCl气体;
(4)氯气有毒,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收,化学式为NaOH,故答案为:NaOH.
点评 本题考查了氯气的实验室制备方法,明确氯气的制备原理和氯气的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
19.已知复分解反应:2CH3COOH+Na2CO3═2CH3COONa+H2O+CO2↑可自发进行.在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
请你判断下列反应不能成立的是( )
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH值 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| A. | CO2+H2O+NaClO═NaHCO3+HClO | B. | CO2+H2O+2NaClO═Na2CO3+2HClO | ||
| C. | CH3COOH+NaCN═CH3COONa+HCN | D. | CH3COOH+NaClO═CH3COONa+HClO |
3.下列物质分类正确的是( )
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、纯碱、石英均为电解质 | D. | 氯水、水玻璃、氨水均为混合物 |
13.已知反应:X+Y=M+N为放热反应,则下列说法正确的是( )
| A. | 断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量 | |
| B. | X和Y的总能量一定高于M和N的总能量 | |
| C. | Y的能量一定高于N | |
| D. | 因为该反应为放热反应,故不必加热就可发生 |
20.下列解释事实的方程式不正确的是( )
| A. | 氨水显碱性:NH3•H2O═NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
17.下列反应或现象与浓硫酸的强氧化性有关的是( )
| A. | 浓硫酸可以干燥SO2、H2等气体 | |
| B. | 常温下浓硫酸可以使Al、Fe发生钝化 | |
| C. | 浓硫酸可以使蔗糖发生炭化 | |
| D. | 用浓硫酸和NaCl固体加热制备HCl气体 |