题目内容
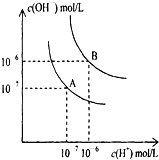 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.(1)若以A点表示25℃时水的电离平衡时的离子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从
(2)100℃时,某酸溶液的pH=4,则该溶液中由水电离产生的H+浓度为
(3)100℃时,某盐NaA溶液的PH=7,则该溶液呈
考点:离子积常数
专题:
分析:(1)根据水的离子积表达式KW=c(H+)?c(OH-)进行计算;
(2)100℃时,水的离子积Kw=10-12,根据在酸溶液中,氢离子几乎全部来自于酸的电离,OH-全部来自于水的电离来计算;
(3)100℃时,水的离子积Kw=10-12,显中性时pH=6;NaA溶液显碱性,说明NaA是强碱弱酸盐,A-是弱酸根,在溶液中水解显碱性;根据NaA溶液中显碱性可知离子浓度大小关系.
(2)100℃时,水的离子积Kw=10-12,根据在酸溶液中,氢离子几乎全部来自于酸的电离,OH-全部来自于水的电离来计算;
(3)100℃时,水的离子积Kw=10-12,显中性时pH=6;NaA溶液显碱性,说明NaA是强碱弱酸盐,A-是弱酸根,在溶液中水解显碱性;根据NaA溶液中显碱性可知离子浓度大小关系.
解答:
解:(1)水的离子积KW=c(H+)?c(OH-),25℃时,KW=c(H+)?c(OH-)=10-7×10-7=10-14;100℃时,KW=c(H+)?c(OH-)=10-6×10-6=10-12,
故答案为:10-14;10-12;
(2)100℃时,水的离子积Kw=10-12,某酸溶液的pH=4,溶液中C(H+)=10-4mol/L,几乎全部来自于酸,而C(OH-)=10-8mol/L全部来自于水,而水电离出的氢离子与水电离出的氢氧根的浓度相等,故溶液中由水电离出的C(H+)=10-8mol/L,故答案为:10-8mol/L;
(3)100℃时,水的离子积Kw=10-12,显中性时pH=6,故pH=7的溶液显碱性;NaA溶液显碱性,说明NaA是强碱弱酸盐,A-是弱酸根,在溶液中水解导致溶液显碱性,故原因是A-+H2O HA+OH-;在NaA溶液中,由于A-水解,导致c(Na+)>c(A-),而盐的单水解程度很小且显碱性,故水解出的c(OH-)>c(H+)且均小于c(A-),故溶液中的离子浓度的关系为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:碱性;A-+H2O
HA+OH-;在NaA溶液中,由于A-水解,导致c(Na+)>c(A-),而盐的单水解程度很小且显碱性,故水解出的c(OH-)>c(H+)且均小于c(A-),故溶液中的离子浓度的关系为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:碱性;A-+H2O HA+OH-;c(Na+)>c(A-)>c(OH-)>c(H+).
HA+OH-;c(Na+)>c(A-)>c(OH-)>c(H+).
故答案为:10-14;10-12;
(2)100℃时,水的离子积Kw=10-12,某酸溶液的pH=4,溶液中C(H+)=10-4mol/L,几乎全部来自于酸,而C(OH-)=10-8mol/L全部来自于水,而水电离出的氢离子与水电离出的氢氧根的浓度相等,故溶液中由水电离出的C(H+)=10-8mol/L,故答案为:10-8mol/L;
(3)100℃时,水的离子积Kw=10-12,显中性时pH=6,故pH=7的溶液显碱性;NaA溶液显碱性,说明NaA是强碱弱酸盐,A-是弱酸根,在溶液中水解导致溶液显碱性,故原因是A-+H2O
 HA+OH-;在NaA溶液中,由于A-水解,导致c(Na+)>c(A-),而盐的单水解程度很小且显碱性,故水解出的c(OH-)>c(H+)且均小于c(A-),故溶液中的离子浓度的关系为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:碱性;A-+H2O
HA+OH-;在NaA溶液中,由于A-水解,导致c(Na+)>c(A-),而盐的单水解程度很小且显碱性,故水解出的c(OH-)>c(H+)且均小于c(A-),故溶液中的离子浓度的关系为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:碱性;A-+H2O HA+OH-;c(Na+)>c(A-)>c(OH-)>c(H+).
HA+OH-;c(Na+)>c(A-)>c(OH-)>c(H+).
点评:本题考查了水的离子积的有关计算和盐溶液不显中性的原因以及离子浓度的大小比较,应注意在计算时温度对Kw的影响.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
以下结构简式表示一种有机物的结构,关于其性质的叙述不正确的是( )
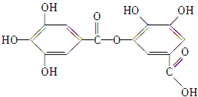

| A、它有酸性,能与纯碱溶液反应 |
| B、可以水解,其水解产物只有一种 |
| C、1 mol该有机物最多能与7 mol NaOH反应 |
| D、该有机物能发生取代反应 |
平衡体系H2CO3?H++HCO3-,HCO3-?H++CO32- 中,溶液中c(OH-)增大时c(CO32-)将( )
| A、增大 | B、减少 |
| C、不变 | D、可能增大也可能减少 |