题目内容
如图所示3套实验装置,分别回答下列问题.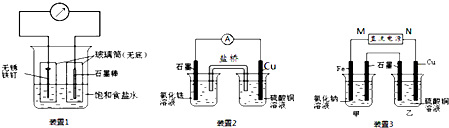
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到的现象为 .
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 .
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①甲烧杯中铁电极的电极反应为 .
②停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为 mL.

(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到的现象为
(2)装置2中的石墨是
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①甲烧杯中铁电极的电极反应为
②停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为
考点:原电池和电解池的工作原理
专题:
分析:(1)装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁为负极,碳为正极,在碳极上氧气得电子生成OH-离子,以此判断现象;
(2)装置2为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2Fe3++2e-═2Fe2+,以此书写电池总反应;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,
②根据电极反应和串联电路各极上转移电子的数目相等进行计算.
(2)装置2为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2Fe3++2e-═2Fe2+,以此书写电池总反应;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,
②根据电极反应和串联电路各极上转移电子的数目相等进行计算.
解答:
解:(1)装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁为负极,碳为正极,在碳极上氧气得电子生成OH-离子,反应的电极反应式为O2+4e-+2H2O═4OH-,所以,铁钉附近的溶液生成蓝色沉淀,碳棒附近的溶液变红,
故答案为:铁钉附近的溶液生成蓝色沉淀,碳棒附近的溶液变红;
(2)装置2为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2Fe3++2e-═2Fe2+,反应的总方程式为2Fe3++Cu═2Fe2++Cu2+,
故答案为:正;2Fe3++Cu═2Fe2++Cu2+;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,
发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
②取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=
=0.224L,即224ml,故答案为:224.
故答案为:铁钉附近的溶液生成蓝色沉淀,碳棒附近的溶液变红;
(2)装置2为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2Fe3++2e-═2Fe2+,反应的总方程式为2Fe3++Cu═2Fe2++Cu2+,
故答案为:正;2Fe3++Cu═2Fe2++Cu2+;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,
发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
②取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
| 0.64g |
| 64g/mol |
根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=
| 22.4L×0.02mol |
| 2mol |
点评:本题考查电化学知识,题目难度中等,做题时注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算.

练习册系列答案
相关题目
吸热反应一定是( )
| A、释放能量 |
| B、反应物总能量等于生成物总能量 |
| C、反应物总能量高于生成物总能量 |
| D、贮存能量 |
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列有关该电池设计的说法不正确的是( )
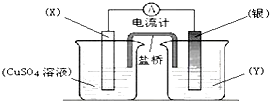

| A、电极X的材料是Cu |
| B、银电极为正极 |
| C、盐桥里Cl-移向电源的负极 |
| D、外电路中每通过0.2mol电子,银电极的质量理论上增加10.8g |
下列离子中,电子数大于质子数且质子数大于中子数的是( )
| A、D3O+ |
| B、Li+ |
| C、OD- |
| D、OH- |
在100mL混合液中,硝酸和硫酸的物质的量浓度分别为1mol/L和4mol/L,向该混合液中加入32.5g锌,微热充分反应后,收集到标准状况下的气体为( )
| A、2.24 L |
| B、7.84 L |
| C、10.08 L |
| D、11.2 L |
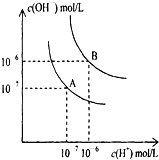 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.

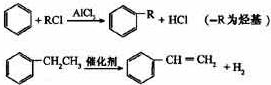 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是