题目内容
7. 氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.
氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.(1)已知反应I:2SO2(g)+O2(g)?2SO3(g),△H=-196.6KJ•mol-1
反应II:2NO(g)+O2(g)?2NO2(g),△H=-113.0KJ•mol-1
则SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热反应方程式为SO2(g)+NO2(g)?NO(g)+SO3(g)△H=-41.8KJ/mol.
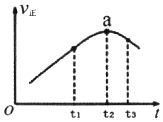
(2)①若在绝热恒容密闭容器中通入一定量的SO2和O2,一定条件下发生反应I,一段时间内,正反应速率随时间变化曲线如图所示,则在a点时,反应未达到(填“达到”或“未达到”)平衡状态;t1~t3时间内,v正先增大后减小的主要原因是t1~t2时间内,v正增大的主要原因是反应放热导致容器内温度升高;t2~t3时间内,v正减小的主要原因是反应物浓度减小.
②若在两个相同绝热恒容密闭容器中分别加入A:2molSO2(g)和1molO2(g);B:2molSO3(g),其它条件相同,发生反应I,达到平衡时,则该反应的平衡常数:A<B(填“>”、“=”、“<”).
(3)已知常温下,H2S的电离常数:K1=1.3×10-7,K2=7.1×10-15,Ksp(H2S)=4×10-53,Ksp(Ag2S)=6.3×10-50,Ksp(HgS)=1.6×10-52,则0.1mol/L H2S溶液的pH约为4(取近似整数值);向浓度均为0.001mol•l-1的AgNO3和Hg(NO3)2混合溶液中通入H2S气体,开始生成沉淀的c(S2-)为1.6×10-49mol/L.
(4)NH3催化还原氮氧物技术(SCR)是目前应用广泛的烟气氮氧化物脱除技术.现有NO、NO2的混合气6L,可用同温同压下7L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3.
分析 (1)根据所给的条件反应,结合要求的目标反应,将条件反应调整计量数并做相应的加减得目标反应,反应热做相应的变化即可;
(2)①由题意可知一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响.结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快;
②根据温度对平衡移动的影响以及K的表达式来计算即可;
(3)已知常温下,H2S的电离常数:K1=1.3×10-7=$\frac{C({H}^{+})C(H{S}^{-})}{C({H}_{2}S)}$,并据pH=-lgc(H+)来计算;据Ksp求算出不同沉淀下的c(S2-),注意浓度小的先沉淀;
(4)设出NO的体积为XL,NO2的体积为YL,则有X+Y=6 ①然后根据和氨气反应时得失电子数守恒可有:2X+4Y=7×3 ②将两式联立即可解得.
解答 解:(1)已知:2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 ①
2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1 ②
将$\frac{①}{2}$-$\frac{②}{2}$可得:SO2(g)+NO2(g)?NO(g)+SO3 (g)△H=$\frac{-196.6kJ/mol}{2}$-$\frac{-113kJ/mol}{2}$=-41.8KJ/mol,
故答案为:SO2(g)+NO2(g)?NO(g)+SO3 (g)△H=-41.8KJ/mol,
(2)①化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,a点对应的正反应速率显然还在改变,故一定未达平衡,只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快;
故答案为:未达到;t1~t2时间内,v正增大的主要原因是反应放热导致容器内温度升高;t2~t3时间内,v正减小的主要原因是反应物浓度减小;
②加入A:2molSO2(g)和1molO2(g);B:2molSO3(g),两种情况的投料是等效的,根据①的分析,反应是放热的,绝热容器中,则体系温度升高,A:2molSO2(g)和1molO2(g)此时K减小,B:2molSO3(g),升高温度,则K增加,所以A<B,故答案为:<;
(3)已知常温下,H2S的电离常数:K1=1.3×10-7,根据K=$\frac{C({H}^{+})C(H{S}^{-})}{C({H}_{2}S)}$,设0.lmol/LH2S溶液的氢离子浓度是x,则$\frac{{x}^{2}}{0.1-x}$=1.3×10-7,解得x≈10-4mol/L,故pH=-lgc(H+)=-lg10-4=4;当Qc=Ksp时开始沉淀,因为Ksp(HgS)=[Hg2+]•[S2-]=[S2-]×1×10-3=1.6×10-52,所以c(S2-)=1.6×10-49mol/L,Ksp(Ag2S)=[Ag+]2•[S2-]=[S2-]×(1×10-3)2=6.3×10-50,所以c(S2-)=6.3×10-44mol/L,因为1.6×10-49mol/L<6.3×10-44mol/L,故沉淀时c(S2-)=1.6×10-49mol/L,
故答案为:4;1.6×10-49mol/L;
所以Ksp=c(Mn2+)•c(S2-)=7×10-12mol•L-1×0.020mol.L-1=2.8×10-13,故答案为:4;2.8×10-13;(4)设出NO的体积为XL,NO2的体积为YL,根据混合气体的体积为6L,则有X+Y=6 ①
氨气反应时,NO和NO2得电子,而氨气失电子,根据得失电子数守恒可有:2X+4Y=7×3 ②
将两式联立即可解得X=1.5,Y=4.5,则有X:Y=1:3,
故答案为:1:3.
点评 本题考查了盖斯定律的应用、化学平衡常数的计算等,综合性较强,难度适中.

CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1
CaO(s)+CO2(g)?CaCO3(s)△H=-172kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-187kJ•mol-1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-228kJ•mol-1.
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)?CH4(g)+2H2O(g)和CaO(s)+CO2(g)?CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
| 物质 N(mol) 时间(min) | CO2 | H2 | CaO |
| 0 | 0.50 | 1.00 | 0.40 |
| 2 | 0.35 | 0.60 | a |
| 6 | 0.20 | 0.20 | b |
| 8 | 0.20 | 0.20 | b |
②b=0.10
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是AC(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2,CaCO3质量减小 D.充入少量CO2,c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的化学平衡常数K=$\frac{2}{3}$.若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为0<x$<\root{4}{0.015}$
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2mol•L-1 NaOH溶液中,下列说法正确的是CD
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32-)>c(OH- )>c(HCO3-)>c(H+)
D.c(OH-)=2c(H2CO3)+c(HCO3- )+c(H+ )
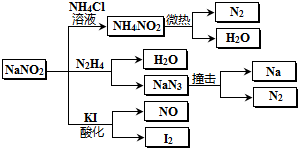
| A. | 分解NaN3盐每产生1molN2 转移6mol e- | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI一淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 |
| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
| A. | Al(OH)3$\stackrel{电解}{→}$ Al$→_{高温}^{Fe_{2}O_{3}}$ Fe | |
| B. | S$\stackrel{O_{2}/点燃}{→}$ SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| C. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$ Cu | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$ FeCl3(aq)$\stackrel{△}{→}$ 无水FeCl3 |
| A. | 0 | B. | 10 | C. | 2 | D. | 8 |
| A. | 简单离子半径:a<c<d<e | |
| B. | 气态氢化物的稳定性e<b<c | |
| C. | 最高价氧化物的水化物酸性b>e | |
| D. | c和d形成的化合物溶于水后溶液呈碱性 |
