题目内容
12.下列叙述中正确的是( )| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
分析 A、H+核外没有电子;
B、核外电子排布相同的粒子,化学性质不一定相同;
C、两种原子若核外电子排布相同,则质子数一定相同;
D、阴离子的核外电子排布一定与本周期的稀有气体原子的核外电子排布相同.
解答 解:A、H+核外没有电子,与稀有气体元素原子的核外电子排布不同,故A错误;
B、核外电子排布相同的粒子,化学性质不一定相同,如Na+和OH-,故B错误;
C、两种原子若核外电子排布相同,则质子数一定相同,一定为同种元素,故C正确;
D、原子获得电子形成阴离子,最外层呈稳定结构,电子层数目不变,阴离子的核外电子排布一定与本周期的稀有气体原子的核外电子排布相同,不是“上一周期”,故D错误.
故选C.
点评 本题考查原子结构和元素的性质,题目难度中等,本题易错点为C,注意阳离子的质子数大于电子数,阴离子的质子数小于电子数的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列晶体熔化时不需破坏化学键的是( )
| A. | 晶体硅 | B. | 食盐 | C. | 金属钾 | D. | 蔗糖 |
3.Na2CO3俗称纯碱,是基本化工原料.下列涉及Na2CO3的方程式中,正确的是( )
| A. | Na2O2与CO2反应生成Na2CO3:Na2O2+CO2═Na2CO3+O2 | |
| B. | Na2CO3溶液呈碱性:CO32-+H2O?H2CO3+OH- | |
| C. | Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+═CO2↑+H2O | |
| D. | 饱和Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4═CaCO3+SO42- |
20.合成药物异搏定路线中某一步骤如图:
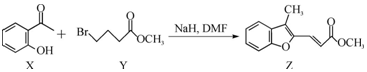
下列说法错误的是( )

下列说法错误的是( )
| A. | 物质X中所有碳原子可能在同一平面内 | |
| B. | 可用FeCl3溶液鉴别Z中是否含有X | |
| C. | 等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为3:5 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
17.用NaOH固体配制0.1mol/L的NaOH溶液,下列操作或说法正确的是( )
| A. | 定容时俯视刻度线,会使所配溶液浓度偏大 | |
| B. | 将4.0gNaOH固体溶于1L水中可配成0.1mol/L的NaOH溶液 | |
| C. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水到刻度线 | |
| D. | 称量时,将固体NaOH放在垫有纸的托盘天平左盘上 |
4.对${\;}_{Z}^{Z+N}$X与${\;}_{Z}^{Z+N+1}$X+两种微粒,下列叙述正确的是( )
| A. | 一定都是由质子、中子、电子组成的 | |
| B. | 质子数一定相同,质量数和中子数一定不相同 | |
| C. | 核电荷数和核外电子数一定相等 | |
| D. | 化学性质几乎完全相同 |
 氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.
氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.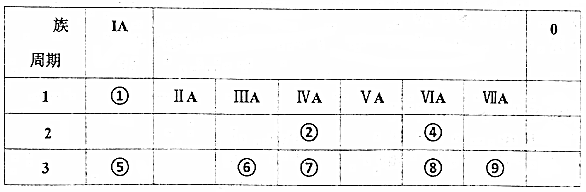
 ;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:
;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
.