题目内容
2.亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,物理性质与NaCl极为相似.相关化学性质如图所示,下列说法不正确的是( )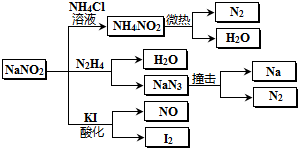
| A. | 分解NaN3盐每产生1molN2 转移6mol e- | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI一淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 |
分析 A.根据NaN3中氮的化合价为-$\frac{1}{3}$,生成1个 N2转移$\frac{2}{3}$个电子分析;
B.根据氧化剂是化合价升高的反应物分析;
C.根据信息可知:NaNO2具有氧化性,在酸性条件下氧化碘化钾,得到单质碘,单质碘遇淀粉溶液变蓝,而NaCl无氧化性;
D.实验室可用亚硝酸钠(NaNO2)固体和氯化铵(NH4Cl)溶液混和加热来制备氮气.
解答 解:A.NaN3中氮的化合价为-$\frac{1}{3}$,生成1个 N2转移$\frac{2}{3}$个电子,则每产生1molN2转移$\frac{2}{3}$mole-,故A错误;
B.NaNO2与N2H4反应生成NaN3,NaNO2是中氮的化合价由+3价降低为-$\frac{1}{3}$,NaNO2是氧化剂,故B正确;
C.NaNO2具有氧化性,在酸性条件下氧化碘化钾,得到单质碘,单质碘遇淀粉溶液变蓝,NaCl无氧化性,在酸性条件下不能氧化碘化钾,所以可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2,故C正确;
D.采用固液加热制取气体的方法,实验室可用亚硝酸钠(NaNO2)固体和氯化铵(NH4Cl)溶液混和加热来制备氮气,NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O,故D正确;
故选A.
点评 本题主要考查了亚硝酸钠的性质和氧化还原的知识,难度不大,注意抓住题目信息来解题.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
19.设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
10.将一小块金属钠长期露置于空气中,最终的产物是( )
| A. | Na2CO3 | B. | Na2O | C. | NaOH | D. | Na2CO3•10H2O |
17.根据化学反应的实质--旧键的断裂和新键的形成,判断下列变化不属于化学变化的是( )
| A. | 固态硫S8加热变成S2蒸气 | B. | 金刚石在一定条件下转化为石墨 | ||
| C. | 干冰变成CO2气体 | D. | Na2O转化为Na2O2 |
14.下列各组中的物质均能发生加成反应的是( )
| A. | 乙烯和乙醇 | B. | 苯和乙醛 | C. | 乙酸和氯乙烯 | D. | 丙醛和丙烷 |
11.下列操作能导致置换反应发生的是( )
| A. | 将铁片置于浓硝酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将金属钠置于CuSO4溶液中 | D. | 将铝粉与氧化铁混合发生铝热反应 |
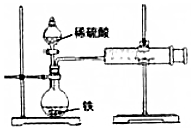 某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.
某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响. 氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.
氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题. (1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式:CH3CH2CH2CH3、CH3CH(CH3)CH3.
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式:CH3CH2CH2CH3、CH3CH(CH3)CH3.