题目内容
17.五种短周期主族元素a、b、c、d、e的原子序数依次增大,a和b可组成种类繁多的化合物,c和e同主族,d和e同周期,且d的焰色反应呈黄色.下列说法正确的是( )| A. | 简单离子半径:a<c<d<e | |
| B. | 气态氢化物的稳定性e<b<c | |
| C. | 最高价氧化物的水化物酸性b>e | |
| D. | c和d形成的化合物溶于水后溶液呈碱性 |
分析 五种短周期主族元素a、b、c、d、e的原子序数依次增大,a和b可组成种类繁多的化合物,则a为H、b为C元素;d的焰色反应呈黄色,则d为Na元素;c和e同主族,d和e同周期,c的原子序数大于b,则c位于第二周期,e位于第三周期,二者位于ⅤA、ⅥA、ⅤⅡA族,据此进行解.
解答 解:五种短周期主族元素a、b、c、d、e的原子序数依次增大,a和b可组成种类繁多的化合物,则a为H、b为C元素;d的焰色反应呈黄色,则d为Na元素;c和e同主族,d和e同周期,c的原子序数大于b,则c位于第二周期,e位于第三周期,二者位于ⅤA、ⅥA、ⅤⅡA族,
A.离子的电子层越多,离子半径越大,电子层相同时离子的核电荷数越大,离子半径越小,则离子半径a<d<c<e,故A错误;
B.非金属性越强,对应气态氢化物的稳定性越强,非金属性:b<e<c,则气态氢化物的稳定性:b<e<c,故B错误;
C.非金属性越强,最高价氧化物对应水合物的酸性越强,非金属性b<e,则最高价氧化物的水化物酸性b<e,故C错误;
D.c可能为N、O、F元素,d为Na元素,Na3N、Na2O、NaF的水溶液都呈碱性,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,推断元素为解答关键,特别是c、e的不确定性,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的逻辑推理能力.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
5.充分燃烧某烃的含氧衍生物,消耗氧气的体积与生成的二氧化碳的体积之比为9:8(相同条件下).则此有机物的最简通式是( )
| A. | Cn(H2O)m | B. | (C2O3)n(H2O)m | C. | (C2H)n(H2O)m | D. | (CO)n(H2O)m |
9.原子序数小于36的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是( )
①XO3-②XO${\;}_{3}^{2-}$ ③XO${\;}_{4}^{2-}$ ④XO${\;}_{4}^{3-}$.
①XO3-②XO${\;}_{3}^{2-}$ ③XO${\;}_{4}^{2-}$ ④XO${\;}_{4}^{3-}$.
| A. | ①② | B. | ②③ | C. | ①④ | D. | 只有① |
6.化学与生活、人类生产、社会可持续发展密切相关,下列有关说法错误的是( )
| A. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| C. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 | |
| D. | 双氧水、高锰酸钾溶液可以完全杀死埃博拉病毒,其消毒原理与漂白粉消毒的原理相似 |
19.化学与环境、材料、信息、能源、医药等关系密切,下列说法正确的是( )
| A. | 合成纤维、光导纤维都属于有机高分子材料 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 天津港爆炸案对剧毒的氰化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| D. | 利用加热的方法杀死人体内感染的埃博拉病毒 |
 氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.
氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.
 (1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式:CH3CH2CH2CH3、CH3CH(CH3)CH3.
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式:CH3CH2CH2CH3、CH3CH(CH3)CH3.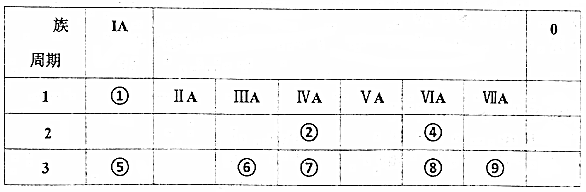
 ;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:
;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
.