题目内容
5.甲同学采用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体.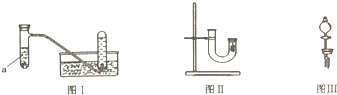
(1)写出试管a中铜与稀硝酸发生反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)乙同学认为甲虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是在铜和稀硝酸反应容器的上部看到了红棕色气体.
(3)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请将表格中的实验现象填完整.
| 实验步骤 | 问题 |
| 1.从U型管左端加入稀硝酸直至充满U型管右端 | / |
| 2.用附有铜丝的胶塞塞住U型管右端,观察现象 | U型管右端产生无色气体,溶液变蓝色 |
| 3.待反应停止后打开胶塞,观察实验现象 | 现象是无色气体与空气接触后立即变成红棕色 |
(5)若将32g铜与175mL一定浓度的硝酸巧合完全反应,只产生NO和NO2气体共16.8L(标准状况时体积),该硝酸的物质的量浓度为10mol•L-1.
分析 (1)根据铜与稀硝酸的反应写出相应的反应方程式3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O,再改写成离子反应方程式;
(2)根据观察到的现象确定并写出反应方程式;
(3)根据生成物的颜色推断现象;根据一氧化氮的性质推断现象;
(4)丙同学实验存在一定的缺陷,生成的NO进入空气中污染大气,同时生成的红棕色NO2被空气稀释颜色较浅,效果不明显,故丁同学用分液漏斗代替,可以缓冲空气稀释生成的NO2气体,效果明显,操作时只要将分液漏斗的瓶塞打开即可;
(5)溶解的Cu为32g,物质的量为32g÷64g/mol=0.5mol,标况下产生NO和NO2气体共16.8L,气体的物质的量为16.8L÷22.4L/mol=0.75mol,结合原子守恒可计算参加反应的硝酸的物质的量,再根据c=n/V,计算硝酸溶液的物质的量浓度.
解答 解:(1)铜和稀硝酸反应的方程式为:3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O,则发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)一氧化氮不稳定,和空气中的氧气在容器的上部反应生成红棕色的二氧化氮气体,反应方程式为2NO+O2=2NO2.
故答案为:在铜和稀硝酸反应容器的上部看到了红棕色气体;
(3)3、一氧化氮不稳定,和空气中的氧气反应生成红棕色的二氧化氮气体,所以在与空气接触后立即变成红棕色.
故答案为:无色气体与空气接触后立即变成红棕色;
(4)无色气体与空气接触后立即变成红棕色,所以与第3步相同;利用外界大气压把溶液压入试管中,所以要打开分液漏斗上部的塞子;使分液漏斗内的溶液进入试管,还要慢慢打开分液漏斗的活塞;防止生成的一氧化氮污染大气,所以待液面与胶塞接触时立即关闭活塞,故答案为:3;拿下分液漏斗瓶塞;
(5)溶解的Cu为32g,物质的量为32g÷64g/mol=0.5mol,则生成0.5molCu(NO3)2,需要消耗硝酸的物质的量为0.5mol×2=1mol,标况下产生NO和NO2气体共16.8L,气体的物质的量为16.8L÷22.4L/mol=0.75mol,则被还原的硝酸的物质的量为0.75mol,结合原子守恒参加反应的硝酸的物质的量为1mol+0.75mol=1.75mol,根据c=n/V,硝酸溶液的物质的量浓度为$\frac{1.75mol}{0.175L}$=10mol/L,故答案为:10mol/L.
点评 本题以硝酸的性质为载体考查了氧化还原反应的有关计算,本题计算量较大,所以计算时要认真、仔细,否则容易出错;要注意反应中部分硝酸参加氧化还原反应,运用原子守恒的解题方法较方便.

| A. | 常温常压下,4.4g CO2物质的量为0.1mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1NA个H2O分子含有氧分子数为1mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
| A. | 制纯碱:往NaOH溶液中 通入少量CO2气体,再蒸发溶液 | |
| B. | 制氯气:以粗盐为原料,经过除杂、浓缩得饱和食盐水,再进行电解所得溶液 | |
| C. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,再用H2还原得镁 | |
| D. | 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )| A. | 乙醇可以用来制饮料 | |
| B. | 1 mol乙醇完全燃烧时生成3mol水 | |
| C. | 1mol乙醇与足量的钠作用生成1g H2 | |
| D. | 物质的量相同的乙醇和乙烯气体完全燃烧,耗氧量相同 |
| A. | ②③ | B. | ③⑤ | C. | ①④ | D. | ③⑥ |
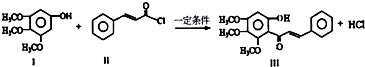
| A. | Ⅰ在空气中不能稳定存在 | |
| B. | 可用FeCl3溶液鉴别有机物Ⅱ和Ⅲ | |
| C. | Ⅱ中所有原子一定不可能共面 | |
| D. | 1mol产物Ⅲ与足量溴水反应,消耗Br2 的物质的量为1.5mol |
| A. | 产物中的SO42-有一部分是氧化产物 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 发生氧化反应和发生还原反应的FeS2之比为7:3 | |
| D. | 14mol CuSO4能氧化5molFeS2 |
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
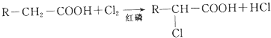
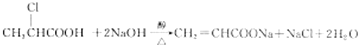 .
.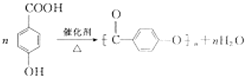 .
. .
.