题目内容
10.CO(g)+Cl2(g)?COCl2(g)△H<0,当反应达到平衡时,下列措施:①升温、②加压、③增加Cl2的浓度④加催化剂⑤恒压通入惰性气体⑥恒容通入惰性气体.能提高CO转化率的是( )| A. | ②③ | B. | ③⑤ | C. | ①④ | D. | ③⑥ |
分析 可逆反应CO(g)+Cl2(g)?COCl2(g)△H<0是气体体积缩小的放热反应,转化率的变化根据化学平衡的移动方向分析判断,
①升温平衡向吸热反应方向移动;
②该反应是气体体积缩小的反应,加压平衡向正反应方向移动;
③加压平衡向气体体积缩小的方向进行,平衡正向进行;
④加催化剂,改变速率不改变平衡;
⑤恒压通入惰性气体,相对于减小反应体系压强,平衡逆向移动;
⑥恒容通入惰性气体,各组分的浓度不变,反应速率不变.
解答 解:化学反应CO(g)+Cl2(g)?COCl2(g)△H<0,正反应是气体体积减小的放热反应,
①升温平衡向逆反应移动,CO转化率减小,故①错误;
②加压平衡向正反应方向移动,CO的转化率增大,故②正确;
③增加Cl2的浓度,平衡向正反应方向移动,CO的转化率增大,故③正确;
④加催化剂,改变速率不改变平衡,CO转化率不变,故④错误;
⑤恒压通入惰性气体,压强增大,为保持恒压,容器体积增大压强减小,平衡逆向进行,CO的转化率减小,故⑤;
⑥恒容通入惰性气体,各组分的浓度不变,平衡不移动,故⑥错误;
故选A.
点评 本题考查了化学平衡的影响因素,题目难度中等,明确影响化学平衡的因素为解答关键,注意理解通入惰性气体对平衡移动影响,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
1.铁钉与碳棒用导线连接后,同时浸入0.1mol•L-1的NaCl溶液中,可能发生的反应是( )
| A. | 碳棒上放出氯气 | B. | 碳棒上放出氧气 | C. | 碳棒附近产生OH- | D. | 铁钉被还原 |
18.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 达到化学平衡时,v正=v逆=0 | |
| B. | 化学反应速率关系是2v(NH3)=3v(H2O) | |
| C. | 达到化学平衡时,O2的浓度不再改变 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
5.甲同学采用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体.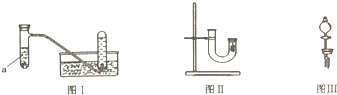
(1)写出试管a中铜与稀硝酸发生反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)乙同学认为甲虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是在铜和稀硝酸反应容器的上部看到了红棕色气体.
(3)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请将表格中的实验现象填完整.
(4)丁同学认为丙的实验存在缺陷.用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第3步骤的相同.丁同学要将一氧化氮气体排入分液漏斗中应进行的正确操作是①拿下分液漏斗瓶塞②慢慢打开分液漏斗的活塞③待液面与胶塞接触时立即关闭活塞.
(5)若将32g铜与175mL一定浓度的硝酸巧合完全反应,只产生NO和NO2气体共16.8L(标准状况时体积),该硝酸的物质的量浓度为10mol•L-1.

(1)写出试管a中铜与稀硝酸发生反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)乙同学认为甲虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是在铜和稀硝酸反应容器的上部看到了红棕色气体.
(3)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请将表格中的实验现象填完整.
| 实验步骤 | 问题 |
| 1.从U型管左端加入稀硝酸直至充满U型管右端 | / |
| 2.用附有铜丝的胶塞塞住U型管右端,观察现象 | U型管右端产生无色气体,溶液变蓝色 |
| 3.待反应停止后打开胶塞,观察实验现象 | 现象是无色气体与空气接触后立即变成红棕色 |
(5)若将32g铜与175mL一定浓度的硝酸巧合完全反应,只产生NO和NO2气体共16.8L(标准状况时体积),该硝酸的物质的量浓度为10mol•L-1.
15.常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A. | ④和②混合溶液中:c(H+)=c(OH-) | |
| B. | ①与④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | ②和③混合溶液中:c(H+)>c(OH-) | |
| D. | 四种溶液稀释100倍,溶液pH:③>④>②>① |
2.天然纤维的吸湿性优于合成纤维,合成纤维中吸湿性较好的是( )
| A. |  涤纶 涤纶 | B. |  氯纶 氯纶 | ||
| C. |  丙纶 丙纶 | D. |  维纶 维纶 |
19.“地球一小时”熄灯活动,以倡导节能减排理念.下列不能达到节能减排目的是( )
| A. | 利用太阳能发电 | B. | 用家用汽车代替公交车 | ||
| C. | 利用化石燃料制造燃料电池 | D. | 用节能灯代替白炽灯 |
20. 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H22O4 | B. | 具有较强的还原性 | ||
| C. | 可用蒸馏水提取植物中的青蒿素 | D. | 碱性条件下能发生水解反应 |
