题目内容
15.自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4.在该反应中( )| A. | 产物中的SO42-有一部分是氧化产物 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 发生氧化反应和发生还原反应的FeS2之比为7:3 | |
| D. | 14mol CuSO4能氧化5molFeS2 |
分析 Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,FeS2既是氧化剂又是还原剂,从元素化合价的角度判断并计算该题.
解答 解:A、由化学方程式可知,反应物中含有14molSO42-离子,生成物中有17molSO42-离子,则有3molS被氧化,产物中的SO42-有一部分是氧化产物,故A正确;
B、5molFeS2发生反应,Cu元素化合价由+2价→+1价,14molCuSO4得到14mol电子,FeS2→Cu2S,S元素的化合价由-1价→-2价,生成7molCu2S,得到7mol电子,有21mol电子转移,故B错误;
C、由方程式可知,5molFeS2参加反应,生成7molCu2S,被还原,所以发生还原反应的FeS2为3.5mol,但是发生氧化反应的FeS2还有1.5mol,发生氧化反应和发生还原反应的FeS2之比为3:7,故C错误;
D、Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2既是氧化剂又是还原剂,是14molCuSO4还有一部分FeS2做氧化剂,所以14mol硫酸铜氧化FeS2小于5mol,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子数的考查,题目难度不大.

练习册系列答案
相关题目
5.甲同学采用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体.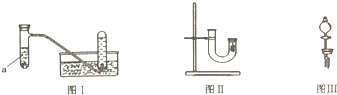
(1)写出试管a中铜与稀硝酸发生反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)乙同学认为甲虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是在铜和稀硝酸反应容器的上部看到了红棕色气体.
(3)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请将表格中的实验现象填完整.
(4)丁同学认为丙的实验存在缺陷.用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第3步骤的相同.丁同学要将一氧化氮气体排入分液漏斗中应进行的正确操作是①拿下分液漏斗瓶塞②慢慢打开分液漏斗的活塞③待液面与胶塞接触时立即关闭活塞.
(5)若将32g铜与175mL一定浓度的硝酸巧合完全反应,只产生NO和NO2气体共16.8L(标准状况时体积),该硝酸的物质的量浓度为10mol•L-1.

(1)写出试管a中铜与稀硝酸发生反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)乙同学认为甲虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是在铜和稀硝酸反应容器的上部看到了红棕色气体.
(3)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请将表格中的实验现象填完整.
| 实验步骤 | 问题 |
| 1.从U型管左端加入稀硝酸直至充满U型管右端 | / |
| 2.用附有铜丝的胶塞塞住U型管右端,观察现象 | U型管右端产生无色气体,溶液变蓝色 |
| 3.待反应停止后打开胶塞,观察实验现象 | 现象是无色气体与空气接触后立即变成红棕色 |
(5)若将32g铜与175mL一定浓度的硝酸巧合完全反应,只产生NO和NO2气体共16.8L(标准状况时体积),该硝酸的物质的量浓度为10mol•L-1.
6.下列有关化学用语表达不正确的是( )
| A. | CO2的电子式: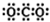 | |
| B. | CS2分子的结构式:S═C═S | |
| C. | S2-的结构示意图: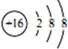 | |
| D. | 8个中子的碳原子的核素符号:${\;}_{8}^{14}$C |
3.有关化学用语的表述正确的是( )
| A. | 轨道表示式表示N2中的共用电子对: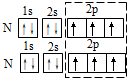 | |
| B. |  只能是氢分子的比例模型 只能是氢分子的比例模型 | |
| C. |  只能是氮分子的球棍模型 只能是氮分子的球棍模型 | |
| D. | CH4分子的比例模型: |
10.由右表提供数据及相关物质结构知识,反应:SiCl4(g)+2H2(g)→Si(s)+4HCl(g),生成1mol晶体硅的热效应是( )
| 化学键 | Si-Cl | H-H | Si-Si | H-Cl |
| 键能(kJ/mol) | 360 | 436 | 176 | 431 |
| A. | 吸收236kJ | B. | 放出236kJ | C. | 放出116kJ | D. | 吸收116kJ |
20. 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H22O4 | B. | 具有较强的还原性 | ||
| C. | 可用蒸馏水提取植物中的青蒿素 | D. | 碱性条件下能发生水解反应 |
7.下列说法错误的是( )
| A. | 提纯液体混合物常用重结晶法 | |
| B. | 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 | |
| C. | 萃取是利用溶质在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂的操作 | |
| D. | 常用质谱法进行有机物相对分子质量的测定 |
4.研究表明:海产品内含有对人体无害的+5价砷(As)元素,但砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜(富含维生素C),否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的是( )
| A. | 维生素C能将+5价砷氧化成As2O3 | |
| B. | 维生素C具有还原性 | |
| C. | 同时大量食用海鲜和青菜过程中+5价砷发生还原反应 | |
| D. | 同时大量食用海鲜和青菜过程中维生素C被氧化 |
5.用来解释下列事实的方程式不正确的是( )
| A. | 钢铁发生吸氧腐蚀的正极反应:O2+4e-+2H2O═4OH- | |
| B. | 将氯气通入石灰乳制备漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| C. | 向Na2SiO3溶液中通过量CO2制备硅酸凝胶:SiO32-+2CO2+2H2O═H2SiO3+2HCO3- | |
| D. | 溶质物质的量比为1:1的明矾溶液和Ba(OH)2溶液混合:2SO42-+2Ba2++Al3++4OH-═AlO2-+2BaSO4↓+2H2O |