题目内容
16.关于物质的量的叙述正确的是( )| A. | 常温常压下,4.4g CO2物质的量为0.1mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1NA个H2O分子含有氧分子数为1mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
分析 A.根据n=$\frac{m}{n}$计算出4.4g二氧化碳的物质的量;
B.根据n=$\frac{m}{n}$计算出6.2g氧化钠的物质的量,再根据氧化钠的化学式计算出含有钠离子的物质的量;
C.1NA个H2O分子的物质的量为1mol,含有1mol氧原子,不存在氧气分子;
D.标准状况下,乙醇的状态不是气体.
解答 解:A.4.4g二氧化碳的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,故A正确;
B.6.2g氧化钠的物质的量为:$\frac{6.2g}{62g/mol}$=0.1mol,0.1mol氧化钠中含有0.2mol钠离子,故B错误;
C.1NA个H2O分子的物质的量为1mol,1mol水分子中含有1mol氧原子,不含有氧分子,故C错误;
D.标准状况下,乙醇不是气体,不能使用标准状况下的气体摩尔体积计算22.4L乙醇的物质的量,故D错误;
故选A.
点评 本题考查了有关物质的量的简单计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数等之间的关系为解答关键,D为易错点,注意明确标准状况下气体摩尔体积的使用条件.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.将20mL0.8mol•L-1H2SO4溶液加水稀释到100mL,稀释后H2SO4溶液中的物质的量浓度为( )
| A. | 0.2mol•L-1 | B. | 0.16mol•L-1 | C. | 0.32mol•L-1 | D. | 0.08mol•L-1 |
1.铁钉与碳棒用导线连接后,同时浸入0.1mol•L-1的NaCl溶液中,可能发生的反应是( )
| A. | 碳棒上放出氯气 | B. | 碳棒上放出氧气 | C. | 碳棒附近产生OH- | D. | 铁钉被还原 |
8.莫尔盐[(NH4)2Fe(SO4)2•6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L 的该盐的溶液中,下列有关比较正确的是( )
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(H+)=c(OH-)+c(NH3•H2O) | ||
| C. | c(SO42-)+c(OH-)=c(NH4+)+c(Fe2+)+c(H+) | D. | c(NH3•H2O)+c(NH4+)=0.1 mol/L |
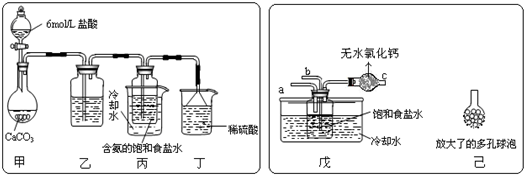
5.甲同学采用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体.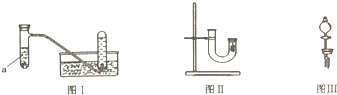
(1)写出试管a中铜与稀硝酸发生反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)乙同学认为甲虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是在铜和稀硝酸反应容器的上部看到了红棕色气体.
(3)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请将表格中的实验现象填完整.
(4)丁同学认为丙的实验存在缺陷.用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第3步骤的相同.丁同学要将一氧化氮气体排入分液漏斗中应进行的正确操作是①拿下分液漏斗瓶塞②慢慢打开分液漏斗的活塞③待液面与胶塞接触时立即关闭活塞.
(5)若将32g铜与175mL一定浓度的硝酸巧合完全反应,只产生NO和NO2气体共16.8L(标准状况时体积),该硝酸的物质的量浓度为10mol•L-1.

(1)写出试管a中铜与稀硝酸发生反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)乙同学认为甲虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是在铜和稀硝酸反应容器的上部看到了红棕色气体.
(3)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请将表格中的实验现象填完整.
| 实验步骤 | 问题 |
| 1.从U型管左端加入稀硝酸直至充满U型管右端 | / |
| 2.用附有铜丝的胶塞塞住U型管右端,观察现象 | U型管右端产生无色气体,溶液变蓝色 |
| 3.待反应停止后打开胶塞,观察实验现象 | 现象是无色气体与空气接触后立即变成红棕色 |
(5)若将32g铜与175mL一定浓度的硝酸巧合完全反应,只产生NO和NO2气体共16.8L(标准状况时体积),该硝酸的物质的量浓度为10mol•L-1.
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. 取6根铁钉,6支干净的试管及其他材料,如图所示.
取6根铁钉,6支干净的试管及其他材料,如图所示. ;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.
;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.