题目内容
19.下列物质的转化在给定条件下能实现的是( )①NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{电解}{→}$Al
②NH3$→_{△}^{O_{2}催化剂}$NO$\stackrel{O_{2}、H_{2}O}{→}$HNO3
③H2SiO3$\stackrel{△}{→}$SiO2$→_{高温}^{C}$CO2
④FeS2$\stackrel{燃烧}{→}$SO2$\stackrel{H_{2}O_{2}}{→}$H2SO4.
| A. | ②③ | B. | ①④ | C. | ②④ | D. | ③④ |
分析 ①氯化铝为共价化合物,熔融氯化铝不导电;
②氨气的催化氧化会生成一氧化氮,一氧化氮和氧气与水反应得到硝酸;
③二氧化硅与C在高温下反应生成的是CO;
④FeS2和氧气反应生成二氧化硫,双氧水能够将二氧化硫氧化成硫酸.
解答 解:①NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3能够实现,但AlCl3为共价化合物,无法电解氯化铝获得铝,故①错误;
②氨气的催化氧化会生成一氧化氮,一氧化氮、氧气、水反应可得到硝酸,转化关系NH3$→_{△}^{O_{2}催化剂}$NO$\stackrel{O_{2}、H_{2}O}{→}$HNO3能够实现,故②正确;
③,H2SiO3$\stackrel{△}{→}$SiO2可以实现,但二氧化硅与C在高温下反应生成Si和CO,无法得到CO2,故③错误;
④FeS2和氧气反应生成二氧化硫,双氧水具有强氧化性,能够将二氧化硫氧化成硫酸,转化关系FeS2$\stackrel{燃烧}{→}$SO2$\stackrel{H_{2}O_{2}}{→}$H2SO4可以实现,故④正确;
故选C.
点评 本题考查常见元素及其化合物的性质,题目难度不大,明确常见元素及其化合物性质为解答关键,试题侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
10.化学与生活、生产、可持续发展密切相关,下列说法正确的是( )
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 | |
| D. | 高纯度的SiO2可以制成光电池将光能直接转换为化学能 |
11.水是自然界最重要的分散剂,关于水的叙述错误的是( )
| A. | 水分子是含极性键的极性分子 | |
| B. | 水的电离方程式为:H2O?2H++O2- | |
| C. | 重水(D2O)分子中,各原子质量数之和是质子数之和的两倍 | |
| D. | 相同质量的水具有的内能:固体<液体<气体 |
14.下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是( )
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Fe与Cl2.
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Fe与Cl2.
| A. | ①③④⑥ | B. | ①④⑥ | C. | ①④ | D. | ①③④ |
11.25℃时,下列各组离子在指定溶液中可能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 无色溶液中:Cu2+、Al3+、NH4+、Cl- | |
| C. | 由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| D. | 0.1mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
8.在一定温度下,反应:2A(s)+2B(g)?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
| A. | A的质量不再改变 | |
| B. | 混合气的密度不再随时间而变化 | |
| C. | 容器内的压强不随时间而变化 | |
| D. | 单位时间内生成2a mol B,同时生成a mol C |
9.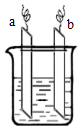 如图中ab相连后,两电极上发生的电极反应分别为:
如图中ab相连后,两电极上发生的电极反应分别为:
a极:2Ag++2e-=2Ag b极:Zn-2e-=Zn2+
下列说法不正确的是( )
 如图中ab相连后,两电极上发生的电极反应分别为:
如图中ab相连后,两电极上发生的电极反应分别为:a极:2Ag++2e-=2Ag b极:Zn-2e-=Zn2+
下列说法不正确的是( )
| A. | a极材料一定为金属银 | |
| B. | b极为负极 | |
| C. | 装置中电解质溶液一定含有Ag+ | |
| D. | 装置中发生的反应方程式一定是Zn+2Ag+=Zn2++2Ag |
 (1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.