题目内容
9.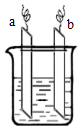 如图中ab相连后,两电极上发生的电极反应分别为:
如图中ab相连后,两电极上发生的电极反应分别为:a极:2Ag++2e-=2Ag b极:Zn-2e-=Zn2+
下列说法不正确的是( )
| A. | a极材料一定为金属银 | |
| B. | b极为负极 | |
| C. | 装置中电解质溶液一定含有Ag+ | |
| D. | 装置中发生的反应方程式一定是Zn+2Ag+=Zn2++2Ag |
分析 a极:2Ag++2e-=2Ag,说明银离子在a极上得电子发生还原反应,电解质溶液中一定含有银离子;b极:Zn-2e-=Zn2+,说明锌作负极失电子发生氧化反应,正极材料可以是比锌活泼性差的金属或非金属,据此解答.
解答 解:A.正极材料可以是比锌活泼性差的金属或非金属,不一定是银,故A错误;
B.b极是锌发生失电子的氧化反应,则b极为负极,故B正确;
C.正极是银离子得电子发生还原反应,电解质溶液中一定含有银离子,故C正确;
D.a极:2Ag++2e-=2Ag,b极:Zn-2e-=Zn2+,则总反应为:Zn+2Ag+=Zn2++2Ag,故D正确;
故选A.
点评 本题考查了原电池的工作原理,为高频考点,侧重于基础知识的考查,注意把握原电池的工作原理,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列说法正确的是( )
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| C. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| D. | 盐酸的酸性强于碳酸,所以非金属性:Cl>C |
14.将两种互不相溶的液体分离的方法是( )
| A. | 分液 | B. | 结晶 | C. | 纸层析 | D. | 过滤 |
18.下列化学方程式或离子方程式正确的是( )
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 草酸溶液中滴加酸性高锰酸钾溶液5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O | |
| C. | 甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2 $\stackrel{△}{→}$ HCOOH+Cu2O↓+2H2O | |
| D. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH- $\stackrel{△}{→}$ CH2=CH2↑+Br-+H2O. |
19.共价键、离子键、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是( )
| A. | SiO2 | B. | CCl4 | C. | NaCl | D. | 金刚石 |
 .
.