题目内容
11.水是自然界最重要的分散剂,关于水的叙述错误的是( )| A. | 水分子是含极性键的极性分子 | |
| B. | 水的电离方程式为:H2O?2H++O2- | |
| C. | 重水(D2O)分子中,各原子质量数之和是质子数之和的两倍 | |
| D. | 相同质量的水具有的内能:固体<液体<气体 |
分析 A.水含H-O,为V型结构,正负电荷的中心不重合;
B.水为弱电解质,存在电离平衡;
C.质量数为2×2+16=20,质子数为1×2+8=10;
D.由固态转化为液态,液态转化为气态,均吸热.
解答 解:A.水含H-O极性键,为V型结构,正负电荷的中心不重合,则为极性分子,故A正确;
B.水为弱电解质,存在电离平衡,电离方程式为H2O?H++OH-,故B错误;
C.质量数为2×2+16=20,质子数为1×2+8=10,则重水(D2O)分子中各原子质量数之和是质子数之和的两倍,故C正确;
D.由固态转化为液态,液态转化为气态,均吸热,气态能量最高,则相同质量的水具有的内能:固体<液体<气体,故D正确;
故选B.
点评 本题考查较综合,涉及弱电解质的电离、分子结构和原子结构、分子能量,为高频考点,把握分子结构与性质为解答的关键,侧重分析与应用能力的考查,注意选项C中氢的质量数判断,题目难度不大.

练习册系列答案
相关题目
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 80℃时,1L pH=1的硫酸溶液中,含有的OH-数目为10-13NA | |
| B. | 含0.1mol NH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| C. | C3H8分子中的2个H原子分别被1个-NH3和1个-OH取代,1mol此有机物所含共同电子对数目为13NA | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子 |
19.X、Y、Z、W、Q是短周期主族元素,其中X原子最外层电子数是内层电子数的3倍;X与Z同主族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期;X、Y、Z三种元素的族序数之和为16.下列说法正确的是( )
| A. | Z与Q形成化合物的电子式为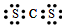 | |
| B. | X与Z、Q形成的化合物均为大气污染物 | |
| C. | Q与W能形成10电子、14电子、18电子分子 | |
| D. | Y、Z、Q分别与X只能组成化学式为AB2型化合物 |
6.离子甲与微粒乙在溶液中的转化关系如图所示,则离子甲不可能是( )

| A. | HCO3- | B. | NH4+ | C. | A13+ | D. | Mg2+ |
16.自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:KCl+Na?NaCl+K+Q (Q<0)
有关数据如表:
(1)请结合平衡移动理论分析,为什么能用该反应制备金属钾.化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾).
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃.
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有适当的升高温度或移去钾蒸气.(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有生产工艺无污染,操作简便.
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=$\frac{c(K)}{c(Na)}$.
有关数据如表:
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃.
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有适当的升高温度或移去钾蒸气.(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有生产工艺无污染,操作简便.
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=$\frac{c(K)}{c(Na)}$.
2.已知反应:
①2H2O(g)=2H2(g)+O2(g)△H1
②Cl2(g)+H2(g)=2HCl△H2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
①2H2O(g)=2H2(g)+O2(g)△H1
②Cl2(g)+H2(g)=2HCl△H2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
| A. | △H1+△H2=△H3 | B. | △H1-△H2=△H3 | C. | △H1+2△H2=△H3 | D. | △H1-2△H2=△H3 |
20.下列说法正确的是( )
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| C. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| D. | 盐酸的酸性强于碳酸,所以非金属性:Cl>C |
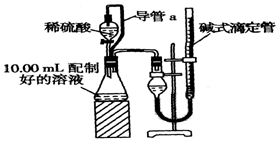 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.