题目内容
11.如表实验操作正确且能达到预期目的是( )| 实验目的 | 操作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁金属活泼性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | ①④⑤ | B. | ②③⑤ | C. | ①②③④⑤⑥ | D. | ①⑤⑥ |
分析 ①钠和水、乙醇反应剧烈程度不同;
②碳碳不饱和键、醛基都可以被酸性高锰酸钾溶液氧化;
③生成的三溴苯酚和溴都易溶于苯中;
④二氧化硫与酸性高锰酸钾发生氧化还原反应;
⑤电解过程中阳离子先得到电子析出的对应金属活泼性弱;
⑥盐溶液水解程度越大,对应酸的酸性越弱.
解答 解:①水中氢氧根离子和乙醇中的羟基氢活泼性不同,与钠反应剧烈程度不同,和水反应剧烈,和乙醇反应缓慢,可以利用和钠反应判断水和乙醇中羟基氢的活泼性强弱,故正确;
②双键和醛基都能使高锰酸钾溶液褪色,欲证明CH2=CHCHO中含有碳碳双键需要先用新制氢氧化铜氧化醛基后再通入高锰酸钾溶液或溴水褪色证明,故错误;
③向混合液中加入浓溴水,充分反应后,苯酚反应,同时溴单质易溶于苯中,引入新的杂质,故错误;
④将SO2通入酸性KMnO4溶液中,发生氧化还原反应,体现二氧化硫的还原剂,与漂白性无关,故错误;
⑤用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液,阴极洗出红色物质铜,表示铜离子的氧化性比镁离子强,即铜金属活泼性比镁弱,故正确;
⑥测同温同浓度Na2CO3和Na2SiO3,可知酸性碳酸大于硅酸,由最高价氧化物水化物的酸性可知非金属性为C>Si,故正确;
正确的有①⑤⑥,
故选D.
点评 本题考查化学实验方案的评价,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
1.下列有关物质的性质与应用均正确的是( )
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同 | |
| C. | Mg(OH)2难溶于水,但可缓慢溶于浓的NH4Cl溶液 | |
| D. | 油脂在酸性条件下可以水解,可用此反应可以制作肥皂 |
2.表是元素周期表的一部分,下列说法正确的是( )
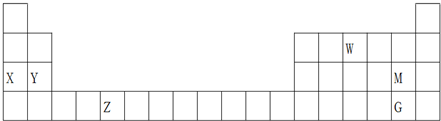

| A. | 最高价氧化物的水化物的碱性:X<Y | |
| B. | W的氢化物的球棍模型为: | |
| C. | 酸性:HMO4<HGO4 | |
| D. | Z的某些化合物可以用作反应的催化剂 |
19.设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LNO和NH3的混合气体中,所含氮原子数为2NA | |
| B. | 1molFe粉与1mol水蒸气充分反应转移的电子数为3NA | |
| C. | 某温度下10LpH=11的NaOH溶液中含OH-的数目为NA,该温度下纯水的pH=6 | |
| D. | 含有阴、阳离子总数为1.5NA的NaHSO3溶液,浓度为0.5mol•L-1 |
6.10g甲物质和7g乙物质恰好完全反应,生成4.4g丙物质、1.8g丁物质和0.1mol戊物质,则戊物质的摩尔质量为( )
| A. | 100g•mol-1 | B. | 108g•mol-1 | C. | 55g•mol-1 | D. | 96g•mol-1 |
16.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,1 mol HF的体积为22.4 L | |
| B. | 常温常压下,1 mol Na2O2与足量SO2反应,转移电子的数目为NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA |
3. 1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
 1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠证明铁的还原性比钠强 | |
| C. | 若用戴维法与盖•吕萨克法制得等量的钠,则两反应各自转移的电子数相同 | |
| D. | 电解熔融氯化钠制钠的电解槽中(如上图),石墨为阳极,铁为阴极 |
20.25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 向10mL 0.1mol•L-1的NaHCO3溶液中滴加3mL0.2mol.L-1盐酸后所得溶液中:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中c(CH3COO-)+c(H+)<c(Na+)+c(OH-) | |
| D. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
10.21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是( )
| A. | 海水含镁,将金属钠放入海水中可以制取金属镁 | |
| B. | 从海水中提取溴的过程涉及氧化还原反应 | |
| C. | 利用潮汐能发电是将化学能转化为电能 | |
| D. | 海底多金属结核矿含有Fe、Mn、Co、B等金属 |