题目内容
18.某无色透明溶液中可能大量存在Ag+、Na+、Fe2+、MnO4-、NH4+中的几种离子,请回答:(1)不做任何实验就可以肯定原溶液中不存在的离子是Fe2+、MnO4-(填离子符号).
(2)取少最试液加入过量稀盐酸有白色沉淀生成,过滤;然后取滤液加入过量的稀NaOH溶液加热,产生刺激性气味的气体,则产生该气体的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
(3)原溶液中可能大量存在的下列阴离子有D
A.Cl- B.OH- C.CO32- D.NO3-.
分析 (1)无色溶液中不存在有色离子,所以不存在Fe2+、MnO4-;
(2)取少最试液加入过量稀盐酸有白色沉淀生成,说明原溶液中有银离子;然后取滤液加入过量的稀NaOH溶液加热,产生刺激性气味的气体,是氨气;
(3)由(2)可知原溶液中有银离子,由此分析;
解答 解:(1)无色溶液中不存在有色离子,所以不存在Fe2+、MnO4-,故答案为:Fe2+、MnO4-;
(2)取少最试液加入过量稀盐酸有白色沉淀生成,说明原溶液中有银离子;然后取滤液加入过量的稀NaOH溶液加热,产生刺激性气味的气体,是氨气,则产生该气体的离子方程式是NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(3)由(2)可知原溶液中有银离子,
A.Cl- 与Ag+不能共存,生成难溶的氯化银,故错误;
B.OH-与Ag+不能共存,生成难溶的氢氧化银,故错误;
C.CO32- 与Ag+不能共存,生成难溶的碳酸银,故错误;
D.NO3-与Ag+不反应,所以能大量共存,故正确;故选D.
点评 本题考查常见离子的检验,切入点是实验现象,根据实验现象结合离子的性质综合分析检验离子是解答本题的关键,题目难度中等.

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
8.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶于1L 水所得的溶液 | |
| B. | 将0.5mol•L-1的NaNO3溶液100mL 加热蒸发掉50g水所得的溶液 | |
| C. | 将23g Na 溶于水并配成1L的溶液 | |
| D. | 含K+为2mol的K2SO4溶液 |
9.在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化.下列有关说法正确的是( )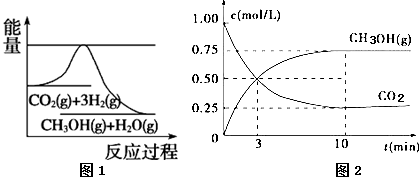
图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化.下列有关说法正确的是( )

| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则$\frac{n({CH}_{3}OH)}{n({CO}_{2})}$增大 | |
| C. | 温度降低,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的平衡常数K增大 | |
| D. | 从反应开始到平衡,用氢气表示的平均反应速率为0.225 mol/(L•min) |
6.肉制品加工中,使用护色剂--亚硝酸钠必须严格控制用量,确保食品安全.某一反应体系共有反应物和生成物六种物质:NaNO2、H2O、NO、I2、NaI、HI.已知该反应中NaNO2只发生了如下过程:NaNO2→NO.下列有关说法不正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:2 | |
| B. | 若有1mol电子转移,则氧化产物的物质的量是0.5mol | |
| C. | 据此反应原理,可以在酸性条件下用淀粉碘化钾试纸检验NO${\;}_{2}^{-}$的存在 | |
| D. | 若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒 |
13.将0.1mol明矾溶于水形成100mL溶液,以下说法正确的是( )
| A. | 明矾净水是利用了明矾的强氧化性 | |
| B. | 溶液的焰色反应为紫色,这是化学性质 | |
| C. | 加入Ba(OH)2溶液至沉淀物质的量达到最大,消耗Ba(OH)2溶液0.2mol | |
| D. | 加入Ba(OH)2溶液至SO42-恰好完全沉淀,Al3+全部转化为AlO2- |
10.把下列四种X的溶液,分别加入盛有10mL 2mol•L-1盐酸的烧杯中,并均加水稀释到50mL,此时X和盐酸缓和地进行反应,其中反应速率最大的是( )
| A. | 20mL 2mol•L-1 | B. | 10mL 5mol•L-1 | C. | 20mL 3mol•L-1 | D. | 10mL 3mol•L-1 |
7.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 10g 质量分数为46%的乙醇水溶液中所含氢原子数为0.6NA | |
| B. | 将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L | |
| C. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为7NA | |
| D. | 6g石英晶体中含有的Si-O键数为0.2NA |
8.某二元弱酸(H2A)溶液按下式发生一级电离和二级电离:H2AHA-+H+HA-A2-+H+下列溶液中C(A2-)最大的是( )
| A. | 0.01 mol•L-1的H2A溶液 | |
| B. | 0.01 mol•L-1NaHA溶液 | |
| C. | 0.02 mol•L-1HCl溶液与0.04 mol•L-1NaHA溶液等体积混合 | |
| D. | 0.02mol•L-1 NaOH溶液0.02 mol•L-1 NaHA溶液等体积混合 |