题目内容
10.有1L0.5mol/LNaOH溶液,取出0.2L后,以下对该溶液的叙述正确的是( )| A. | 该溶液的体积变为0.8L | B. | 该溶液的物质的量浓度为0.5mol/L | ||
| C. | 该溶液的物质的量为0.5mol | D. | 该溶液的物质的量浓度为0.4mol/L |
分析 溶液具有均一性,则取出的溶液的浓度不变,仍然为0.5mol/L;根据物质的量n=cV对各选项进行判断.
解答 解:A.1L溶液中取出0.2L后,剩余溶液体积为0.8L,故A正确;
B.溶液具有均一性,则取出的、剩余的溶液的浓度仍然0.5mol/L,故B正确;
C.该溶液中氢氧化钠的物质的量为:0.5mol/L×1L=0.5mol,无法计算溶液的物质的量,故C错误;
D.溶液具有均一性,所以溶液浓度为0.5mol/L,故D错误;
故选AB.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确溶液具有均一性为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
20.图1是碳的正常循环,但由于过度燃烧化石燃料,造成二氧化碳浓度不断上升.研究和解决二氧化碳捕集、存储和转化问题成为当前化学工作者的重要使命.
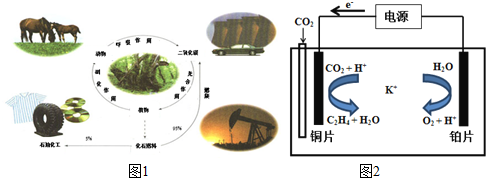
(1)有关碳循环的说法中正确的是ac
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)═2CO(g)+O2(g),该反应的△H>0,(选填:>、<、=).
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质.
2H2O(1)═2H2(g)+O2(g)△H=+571.5kJ•mol-1
3H2(g)+CO2(g)═CH3OH(l)+H2O(1)△H=-137.8kJ•mol-1
则反应:4H2O (1)+2CO2(g)═2CH3OH(l)+3O2(g)△H=+1438.9kJ•mol-1.
你认为该方法需要解决的技术问题有:ab.
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化.
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见下表.( t1<t2<t3)
氨基甲酸铵分解反应是吸热 反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:4×10-6.
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图).在阴极上产生乙烯的电极反应方程式为:2CO2+12H++12e-=CH2=CH2+4H2O.

(1)有关碳循环的说法中正确的是ac
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)═2CO(g)+O2(g),该反应的△H>0,(选填:>、<、=).
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质.
2H2O(1)═2H2(g)+O2(g)△H=+571.5kJ•mol-1
3H2(g)+CO2(g)═CH3OH(l)+H2O(1)△H=-137.8kJ•mol-1
则反应:4H2O (1)+2CO2(g)═2CH3OH(l)+3O2(g)△H=+1438.9kJ•mol-1.
你认为该方法需要解决的技术问题有:ab.
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化.
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见下表.( t1<t2<t3)
温度(℃) 气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图).在阴极上产生乙烯的电极反应方程式为:2CO2+12H++12e-=CH2=CH2+4H2O.
1.把0.1mol MgCl2固体溶于水配成100mL溶液,此溶液中Cl-的物质的量浓度为( )
| A. | 3.Omol•L-1 | B. | 2.Omol•L-1 | C. | O.3mol•L-1 | D. | O.2mol•L-1 |
2.在一定条件下,可与苯发生反应的是( )
| A. | 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 浓硫酸和浓硝酸的混合物 | D. | 氯化氢 |