题目内容
5.(1)已知燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,电池中有一极的电极反应式为2O2十4H2O+8e-═8OH-,这个电极是燃料电池的正极(填“正极”或“负极”),另一个电极上的电极反应式为:CH4+10OH--8e-═CO+7H2O.(2)随着电池不断放电,电解质溶液的碱性减小(填“增大”、“减小”或“不变”).
(3)通常情况下,甲烷燃料电池的能量利用率大于(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
分析 (1)原电池中失电子的电极是负极,负极失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(2)根据溶液中氢氧根离子浓度是否变化判断;
(3)燃料电池中甲烷的利用率较高.
解答 解:(1)甲烷失电子发生氧化反应,所以通入燃料的电极为负极,通入氧化剂的电极为正极,正极上电极反应式为:O2+2H2O+4e-=4OH-,负极上甲烷失电子生成碳酸根离子和水,则负极的电极方程式为:CH4+10OH--8e-═CO+7H2O;
故答案为:正极;CH4+10OH--8e-═CO+7H2O;
(2)已知CH4+2O2+2KOH═K2CO3+3H2O,电池工作一段时间后,因为消耗氢氧化钾所以溶液的碱性减小,
故答案为:减小;
(3)甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高,故答案为:大于.
点评 本题考查了燃料电池,明确原电池正负极上发生的反应是解本题关键,注意溶液的酸碱性对电极反应的影响,题目难度中等,侧重于考查学生的分析能力.

练习册系列答案
 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
15.若已发现了116号元素则下列推断正确的是:①其钠盐的化学式为Na2R ②其最高价氧化物对应的水化物的酸性比硫酸强 ③R是金属元素 ④R是非金属元素 ⑤最外电子层有6个电子( )
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑤ | D. | ③⑤ |
16.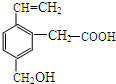 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )
①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.
 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.
| A. | ①②④ | B. | ①②③④⑤ | C. | ①③④⑤⑥ | D. | ①②④⑥ |
20.如图为一原电池装置,下列叙述中正确的是( )
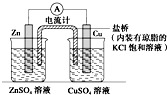

| A. | 该装置中电子由Zn极流向Cu极,CuSO4溶液中的SO41-通过盐桥移向Zn极 | |
| B. | 若装置中的两烧杯中均为CuSO4溶液,则电流计的指针偏转幅度变小,且很快减弱 | |
| C. | 将装置中烧杯内的溶液对换,电流计的指针也能发生偏转 | |
| D. | 将盐桥改为铜导线连接两种溶液,电流方向为由Cu极到Zn极 |
10.有1L0.5mol/LNaOH溶液,取出0.2L后,以下对该溶液的叙述正确的是( )
| A. | 该溶液的体积变为0.8L | B. | 该溶液的物质的量浓度为0.5mol/L | ||
| C. | 该溶液的物质的量为0.5mol | D. | 该溶液的物质的量浓度为0.4mol/L |