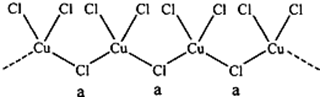
题目内容
6.下列能证明氯化氢是共价化合物的实验事实是( )| A. | 氯化氢不易分解 | B. | 氯化氢溶于水发生电离 | ||
| C. | 液态氯化氢不导电 | D. | 氯化氢的水溶液显酸性 |
分析 共价化合物的构成微粒不带电,则液态不导电,但离子化合物的构成微粒带电,其液态能导电,以此来证明氯化氢是共价化合物.
解答 解:A、不能利用分解来判断是否为共价化合物,如NaCl受热也不易分解,但属于离子化合物,故A错误;
B、共价化合物、离子化合物的溶液都可以电离,故B错误;
C、因共价化合物的构成微粒不带电,离子化合物的构成微粒带电,则可利用液态氯化氢不导电来证明氯化氢是共价化合物,故C正确;
D、氯化氢的水溶液电离产生氢离子,溶液呈酸性,与共价化合物与否无关,故D错误;
故选C.
点评 本题考查共价化合物的判断,明确共价化合物的构成微粒是解答本题的关键,难度不大.

练习册系列答案
相关题目
16. 某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )
某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )
 某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )
某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )| A. | 放电时,外电路的电子由a极移向b极 | |
| B. | 放电时,溶液中H+从左槽移向右槽 | |
| C. | 充电时,a极的反应式为VO2+-e-+H2O=VO2++2H+ | |
| D. | 当左槽溶液颜色由蓝色变为黄色时,电池中能量转化形式为化学能转化为电能 |
17.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | 一定条件下,W单质可以将Z从其氢化物中置换出来 | |
| D. | 常温下,Z单质与W的常见单质直接生成2W2 |
14.氧化钙在2973K时熔化,而NaCl在1074K时熔化,二者的离子间距和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是( )
| A. | 氧化钙晶体中阴、阳离子所带电荷数多 | |
| B. | 氧化钙晶格能比氯化钠的晶格能大 | |
| C. | 两种晶体的晶胞结构类型不同 | |
| D. | 氧化钙、氯化钠的离子间距类似情况下,晶格能主要由阴、阳离子所带电荷数决定 |
1.如图所示是四种分子结构的排列方式,其对应的化学式正确的是( )


| A. | A | B. | B | C. | C | D. | D |
18.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A. | 一个D2O分子所含的中子数为8 | B. | NH3的结构式为 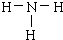 | ||
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | D. | 热稳定性:H2S>HF |
15.已知33As、35Br位于同一周期,下列关系正确的是( )
| A. | 原子半径:As>Cl>Br | B. | 热稳定性:HCl>AsH3>HBr | ||
| C. | 还原性:As3->S2->Cl- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
16.下列说法不正确的是( )
| A. | 16O、18O互为同位素 | |
| B. | 金刚石和石墨互为同素异形体 | |
| C. | 分子式符合通式CnH2n+2且 n 值不同的两种烃互为同系物,而分子式符合通式CnH2n且 n 值不同的两种烃不一定互为同系物 | |
| D. |  互为同分异构体 互为同分异构体 |