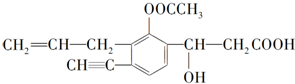
题目内容
14.氧化钙在2973K时熔化,而NaCl在1074K时熔化,二者的离子间距和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是( )| A. | 氧化钙晶体中阴、阳离子所带电荷数多 | |
| B. | 氧化钙晶格能比氯化钠的晶格能大 | |
| C. | 两种晶体的晶胞结构类型不同 | |
| D. | 氧化钙、氯化钠的离子间距类似情况下,晶格能主要由阴、阳离子所带电荷数决定 |
分析 离子晶体熔沸点与晶格能有关,晶格能与离子半径成反比、与电荷成正比,据此分析解答.
解答 解:A.离子晶体熔沸点与晶格能有关,晶格能与离子半径成反比、与电荷成正比,二者离子间距离和晶体结构相似,氧化钙中氧离子所带电荷大于氯离子、钙离子所带电荷大于钠离子,所以导致氧化钙熔点高于氯化钠,故A正确;
B.二者离子间距离和晶体结构相似,氧化钙中氧离子所带电荷大于氯离子、钙离子所带电荷大于钠离子,导致氧化钙晶格能大于氯化钠,故B正确;
C.根据题干知,两种晶体的结构相似,所以两种晶体的晶胞结构相似,故C错误;
D.晶格能与离子半径成反比、与电荷成正比,两种晶体的离子间距离相似,则晶格能取决于离子所带电荷,故D正确;
故选C.
点评 本题考查离子晶体熔沸点比较,为高频考点,明确晶格能大小影响因素是解本题关键,注意正确获取题给信息并灵活运用,侧重考查学生获取信息解答问题能力,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.常温下,HA和HB两种一元酸的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )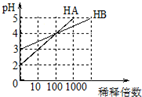

| A. | 向等体积等浓度的HA和HB溶液中滴加等浓度的NaOH溶液,至至溶液呈中性,HB消耗的NaOH多 | |
| B. | 加水稀释HB酸溶液,则c(H+)/c(HB)减小 | |
| C. | 常温下,用pH=a的V1L HA酸与pH=b的V2L NaOH溶液混合,若a+b=14,则反应后溶液呈中性 | |
| D. | 若向等体积等pH的HB和HA酸溶液加入足量锌粉,均反应生成H2,最终HB生成的H2多 |
2.某原子核外电子排布式为ns2np7,它违背了( )
| A. | 泡利原理 | B. | 能量最低原理 | C. | 洪特规则 | D. | 洪特规则特例 |
9.下列有机反应方程式书写正确的是( )
| A. | 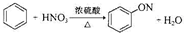 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | CH3COOH+CH3CH2OH $→_{△}^{浓硫酸}$ CH3CH2OCH2CH3+H2O | |
| D. | CH4+2O2 $\stackrel{点燃}{→}$ CO2+2H2O |
19.某粒子用${\;}_{Z}^{A}$Rn+表示,下列关于该粒子的叙述中正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=A+n | D. | 所含质子数=A+Z |
6.下列能证明氯化氢是共价化合物的实验事实是( )
| A. | 氯化氢不易分解 | B. | 氯化氢溶于水发生电离 | ||
| C. | 液态氯化氢不导电 | D. | 氯化氢的水溶液显酸性 |
3.NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )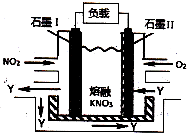

| A. | 放电时,N03-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ附近发生的反应为:NO+O2+e-═NO3- | |
| C. | 电池总反应式为:4NO2+O2═2N2O5 | |
| D. | 当外电路通过4mol e-,负极上共产生2mol N2O5 |
4.下列有机物的命名正确的是( )
| A. | 3,4,4-甲基己烷 | B. | 2-甲基-4-乙基戊烷 | ||
| C. | 2-甲基-3-戊烯 | D. | 2,2-二甲基戊烷 |