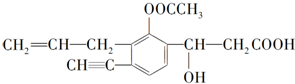
题目内容
16. 某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )
某储能电池的原理如右图所示,溶液中c(H+)=2.0mol/L,阴离子为SO42-,a、b均为惰性电极,充电时右槽的电极反应为V3++e-=V2+.下列叙述正确的是( )| A. | 放电时,外电路的电子由a极移向b极 | |
| B. | 放电时,溶液中H+从左槽移向右槽 | |
| C. | 充电时,a极的反应式为VO2+-e-+H2O=VO2++2H+ | |
| D. | 当左槽溶液颜色由蓝色变为黄色时,电池中能量转化形式为化学能转化为电能 |
分析 充电时右槽的电极反应为V3++e-=V2+,总反应为VO2++V2++2H+ VO2++V3++H2O.
VO2++V3++H2O.
A.放电时,a为正极,b为负极,电子由负极经外电路流向正极;
B.放电时为原电池,电解质溶液中阳离子移向正极;
C.充电过程中,a极是电解池阳极,VO2+发生氧化反应得到VO2+;
D.当左槽溶液颜色由蓝色变为黄色时,即VO2+→VO2+,电池中能量转化形式为电能转化为化学键.
解答 解:充电时右槽的电极反应为V3++e-=V2+,总反应为VO2++V2++2H+ VO2++V3++H2O.
VO2++V3++H2O.
A.放电时,a为正极,b为负极,外电路的电子由b极移向a极,故A错误;
B.放电时为原电池,电解质溶液中阳离子移向正极,即溶液中H+从右槽移向左槽,故B错误;
C.充电过程中,a极是电解池阳极,a极的反应式为VO2+-e-+H2O=VO2++2H+,故C正确;
D.当左槽溶液颜色由蓝色变为黄色时,即VO2+→VO2+,为电解池,电池中能量转化形式为电能转化为化学键,故D错误.
故选C.
点评 本题考查原电池与电解池工作原理,关键是根据充电时右槽的电极反应判断电池总反应,掌握电极判断方法,根据氧化还原反应理解电化学原理.

练习册系列答案
相关题目
7.X、Y、Z、W、M为原子序数依次增大的短周期主族元素.已知:
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
| A. | W、M的离子半径及最高价氧化物对应水化物的碱性皆为M<W | |
| B. | YZ2为直线型的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Y与X形成的化合物的熔沸点一定低于Z与X形成的化合物的熔沸点 | |
| D. | Z与M形成的化合物可作为耐高温材料,W、M、X以1:1:4组成的化合物是应用前景很广泛的储氢材料,具有很强的还原性 |
7.配制一定体积、一定物质的量浓度的溶液,下列操作使配得的溶液浓度偏小的是( )
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 定容时观察液面俯视 | |
| C. | 滴管加水时,有少量水滴到容量瓶外 | |
| D. | 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
4.常温下,HA和HB两种一元酸的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )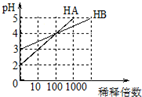

| A. | 向等体积等浓度的HA和HB溶液中滴加等浓度的NaOH溶液,至至溶液呈中性,HB消耗的NaOH多 | |
| B. | 加水稀释HB酸溶液,则c(H+)/c(HB)减小 | |
| C. | 常温下,用pH=a的V1L HA酸与pH=b的V2L NaOH溶液混合,若a+b=14,则反应后溶液呈中性 | |
| D. | 若向等体积等pH的HB和HA酸溶液加入足量锌粉,均反应生成H2,最终HB生成的H2多 |
1.合成氨反应为N2+3H2?2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
| A. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| B. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| C. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 | |
| D. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 |
6.下列能证明氯化氢是共价化合物的实验事实是( )
| A. | 氯化氢不易分解 | B. | 氯化氢溶于水发生电离 | ||
| C. | 液态氯化氢不导电 | D. | 氯化氢的水溶液显酸性 |