题目内容
11.氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为sp3.已知其中一种化合物的化学式为KCuCl3,另一种的化学式为K2CuCl3;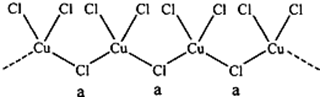
分析 a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,据此判断;一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2,据此书写.
解答 解:a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为sp3,一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2,其化学式为:K2CuCl3,
故答案为:sp3;K2CuCl3.
点评 本题考查了原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,为学习难点和易错点,题目难度中等.

练习册系列答案
相关题目
1.合成氨反应为N2+3H2?2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
| A. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| B. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| C. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 | |
| D. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 |
2.某原子核外电子排布式为ns2np7,它违背了( )
| A. | 泡利原理 | B. | 能量最低原理 | C. | 洪特规则 | D. | 洪特规则特例 |
19.某粒子用${\;}_{Z}^{A}$Rn+表示,下列关于该粒子的叙述中正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=A+n | D. | 所含质子数=A+Z |
6.下列能证明氯化氢是共价化合物的实验事实是( )
| A. | 氯化氢不易分解 | B. | 氯化氢溶于水发生电离 | ||
| C. | 液态氯化氢不导电 | D. | 氯化氢的水溶液显酸性 |
16.下列图示与对应的叙述相符的是( )
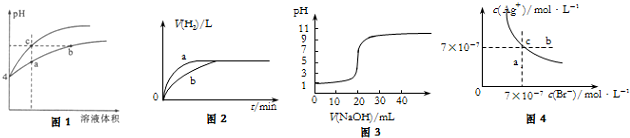

| A. | 图1某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH 变化曲线,用等浓度NaOH溶液分别和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc | |
| B. | 图2中曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)与同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. | 图3表示25℃用0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1 CH3COOH溶液得到的滴定曲线 | |
| D. | 图4表示某温度下AgBr在水中的沉淀溶解平衡曲线的图象,向AgBr的饱和溶液中加入NaBr固体,可以使溶液由c点到b点 |
3.NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )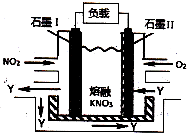

| A. | 放电时,N03-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ附近发生的反应为:NO+O2+e-═NO3- | |
| C. | 电池总反应式为:4NO2+O2═2N2O5 | |
| D. | 当外电路通过4mol e-,负极上共产生2mol N2O5 |
20.由短周期元素和长周期元素共同组成的族可能是( )
| A. | 主族 | B. | 副族 | C. | Ⅷ族 | D. | ⅦB族 |