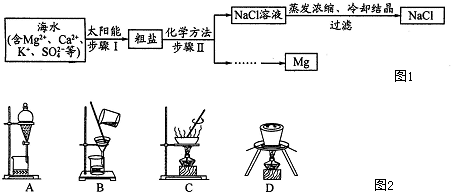
题目内容
无色溶液中含有:①Na+、②Ba2+、③Cl-,④Br-、⑤SO32-、⑥SO42-、⑦Fe2+离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
根据上述实验现象,判断以下结论中正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4、振荡、静置 | CCl4层呈橙色 |
| ③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是①④⑤ |
| B、肯定没有的离子是②⑤⑦ |
| C、可能含有的离子是①②⑥ |
| D、不能确定的离子是①③⑥ |
考点:化学实验方案的评价,常见阳离子的检验,常见阴离子的检验
专题:实验评价题
分析:无色溶液一定不含Fe2+,由步骤①用pH试纸检验pH>7,溶液显碱性,故溶液中一定有SO32-,则不含Ba2+;
②向溶液中滴加氯水,再加入CCl4、振荡、静置,下层呈橙色,可知溶液中含Br-;此步操作会在溶液中引入Cl-,且会将SO32-氧化为SO42-;
③向②所得水溶液加入Ba(NO3)2溶液和稀HNO3,有白色沉淀BaSO4,但不能说明原溶液中有SO42-;
④过滤,向滤液中加入AgNO3溶液和稀HNO3,有白色沉淀产生,不能说明原溶液中有氯离子,以此来解答.
②向溶液中滴加氯水,再加入CCl4、振荡、静置,下层呈橙色,可知溶液中含Br-;此步操作会在溶液中引入Cl-,且会将SO32-氧化为SO42-;
③向②所得水溶液加入Ba(NO3)2溶液和稀HNO3,有白色沉淀BaSO4,但不能说明原溶液中有SO42-;
④过滤,向滤液中加入AgNO3溶液和稀HNO3,有白色沉淀产生,不能说明原溶液中有氯离子,以此来解答.
解答:
解:无色溶液一定不含Fe2+,由步骤①可知,溶液中一定有SO32-,则不含Ba2+;
由步骤②可知溶液中含Br-;
由步骤③可知白色沉淀为硫酸钡,但②中会引入Cl-,且会将SO32-氧化为SO42-,则不能确定是否含SO42-、Cl-;
由步骤④可知白色沉淀为AgCl,但②中会引入Cl-,
又溶液为电中性,一定含阳离子为Na+,
综上所述,一定含①④⑤,可能含③⑥,一定不含②⑦,
故选A.
由步骤②可知溶液中含Br-;
由步骤③可知白色沉淀为硫酸钡,但②中会引入Cl-,且会将SO32-氧化为SO42-,则不能确定是否含SO42-、Cl-;
由步骤④可知白色沉淀为AgCl,但②中会引入Cl-,
又溶液为电中性,一定含阳离子为Na+,
综上所述,一定含①④⑤,可能含③⑥,一定不含②⑦,
故选A.
点评:本题考查化学实验方案的评价,为高频考点,把握离子之间的反应、现象与结论的关系为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析及离子检验中干扰离子的分析,题目难度中等.

练习册系列答案
相关题目
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法错误的是( )


| A、X可能含有2种盐 |
| B、Y可能含有(NH4)2SO4 |
| C、a是SO3 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A、Z的氧化物可与Y的氢化物水溶液发生化学反应 |
| B、X的原子半径比As原子半径小,两者原子序数之差为29 |
| C、W的氧化物对应的水化物是共价化合物,并且必是强酸 |
| D、图中五种元素均是非金属元素,并且Y的非金属性最强 |
X、Y、Z、R和W代表原子序数依次增大的5种短周期元素,X与Z、Y与W同主族,Y是地壳中含量最多的元素,W元素与X元素可以形成18电子的分子,R元素的简单离子是同周期元素中半径最小的,下列说法正确的是( )
| A、R元素最高价氧化物所对应的水化物具有两性,但不会溶于稀氨水 |
| B、Y分别可与X和Z形成原子个数比为1:1的化合物,且形成的化合物晶体类型相同 |
| C、Y的氢化物分子间存在氢键,因此Y的氢化物的稳定性大于W的氢化物的稳定性 |
| D、原子半径从小到大:X<Y<Z<R<W |
下列各反应对应的离子方程式正确的是( )
| A、向Ca(OH)2溶液中加入过量的NaHCO3溶液Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| B、向100 mL 0.12 mol/L-1的Ba(OH)2溶液中通入0.02 mol CO2:Ba2++3OH+2CO2=HCO3+BaCO3↓+H2O |
| C、硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、向含0.1molNaOH和0.1molNa2CO3的溶液中加入1L 0.4mol?L-1稀盐酸OH-+CO32-+3H+=CO2↓+2H2O |
下列说法不正确的是( )
| A、淀粉和纤维素均为高分子化合物,两者都是工业制造酒精的原料 |
| B、CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 |
| C、等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减少 |
D、已知苹果酸的结构简式为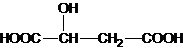 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法不正确的是( )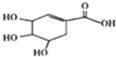

| A、分子式为C7H10O5 |
| B、1mol莽草酸与足量金属钠反应生成2molH2 |
| C、可发生加成反应、取代反应、氧化反应 |
| D、在水溶液中羧基和羟基均能电离出H+ |
 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。