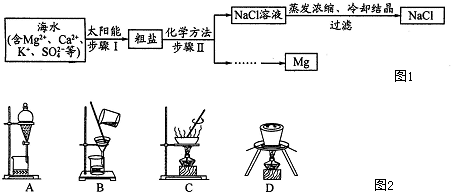
题目内容
试运用所学知识,回答下列问題.
(1)根据下列反应的能量变化示意图,计算2C(s)+O2(g)=2CO(g)△H= .
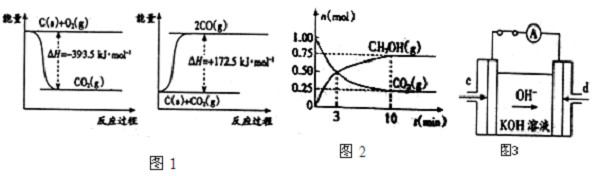
(2)在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线 如图2所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)=
②下列措施中能使化学平衡向正反应方向移动的是 (填序号).
A.升高温度 B、将CH3OH(g)及时液化移出 C.选择高效催化剂D.再充入1molCO2和4molH2
(3)CO2溶于水生成碳酸.巳知下列数据:
现有常a下1mol?L-1(NH4)2CO3,溶液,己知NH4+水解的平衡常数Kb=
,CO32-第一步水解的平衡数Kb=
.
①判断该溶液呈 (填“酸”“中”或“碱”)性,写出该溶液中CO32-发生笫-步水解的离子方程式 .
②下列粒子之间的关系式,其中正确的是 (填序号).
A.c(NH4+)>c(HCO3-)>c(CO32-)>c(NH3?H20)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=1mol?L-1
D.c(NH4+)+c(NH3?H20)=2c(CO32-)+2c(HC03-)+2c(H2CO3)
(4)据报道,科学家在实验室己研制出在燃料电池的反应容器中,利用特殊电极材料以CO和O2为原料做成电池,原理如图3所示.通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式 .
(1)根据下列反应的能量变化示意图,计算2C(s)+O2(g)=2CO(g)△H=

(2)在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线 如图2所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)=
②下列措施中能使化学平衡向正反应方向移动的是
A.升高温度 B、将CH3OH(g)及时液化移出 C.选择高效催化剂D.再充入1molCO2和4molH2
(3)CO2溶于水生成碳酸.巳知下列数据:
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.61×10-1 | Kb=1.77×10 |
| Kw |
| Kb |
| Kw |
| Ka2 |
①判断该溶液呈
②下列粒子之间的关系式,其中正确的是
A.c(NH4+)>c(HCO3-)>c(CO32-)>c(NH3?H20)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=1mol?L-1
D.c(NH4+)+c(NH3?H20)=2c(CO32-)+2c(HC03-)+2c(H2CO3)
(4)据报道,科学家在实验室己研制出在燃料电池的反应容器中,利用特殊电极材料以CO和O2为原料做成电池,原理如图3所示.通入CO的管口是
考点:弱电解质在水溶液中的电离平衡,反应热和焓变,原电池和电解池的工作原理,物质的量或浓度随时间的变化曲线
专题:
分析:(1)据图书写C燃烧生成二氧化碳和C与二氧化碳反应生成CO的热化学方程式,再利用盖斯定律求得焓变;
(2)①根据v=
计算;②根据平衡移动原理解答,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
(3)①根据CO32-第一步水解的平衡常数大于NH4+水解的平衡常数可知溶液呈碱性;碳酸根离子分步水解,第一步水解水解生成氢氧根离子和碳酸氢根离子;
②根据电荷守恒、物料守恒和质子守恒分析;
(4)先根据原电池中阴离子流向负极,确定正负极,然后根据燃料电池中燃料作还原剂,在负极失去电子发生还原反应.
(2)①根据v=
| △c |
| △t |
(3)①根据CO32-第一步水解的平衡常数大于NH4+水解的平衡常数可知溶液呈碱性;碳酸根离子分步水解,第一步水解水解生成氢氧根离子和碳酸氢根离子;
②根据电荷守恒、物料守恒和质子守恒分析;
(4)先根据原电池中阴离子流向负极,确定正负极,然后根据燃料电池中燃料作还原剂,在负极失去电子发生还原反应.
解答:
解:(1)据图可知①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol,据盖斯定律①+②得:C(s)+CO2(g)=2CO(g)△H=-221.0kJ/mol,故答案为:-221.0kJ/mol;
(2)①利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol):1 3 0 0
变化(mol):0.75 2.25 0.75 0.75
平衡(mol):0.25 0.75 0.75 0.75
从反应开始到平衡,H2O的平均反应速率v(H2O)=
=0.0375 mol?L-1?min-1,
故答案为:0.0375 mol?L-1?min-1;
②A、因正反应放热,升高温度平衡向逆反应方向移动,故A错误;
B、将CH3OH(g)从体系中分离,平衡向正反应方法移动,故B正确;
C、催化剂不影响平衡移动,故C错误;
D、再充入1mol CO2和4mol H2,反应物浓度增大,平衡向正反应方向移动,故D正确;
故答案为:BD;
(3)①CO32-第一步水解的平衡常数
大于NH4+水解的平衡常数
大,可知溶液呈碱性;碳酸根离子分步水解,第一步水解水解生成氢氧根离子和碳酸氢根离子,其水解方程式为:CO32-+H2O?HCO3-+OH-;
故答案为:碱;CO32-+H2O?HCO3-+OH-;
②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3?H2O),故A错误;
B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故B错误;
C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1 ,故C正确;
D.溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3?H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;
故答案为:CD;
(4)由图可知,氢氧根离子流向负极,则d为负极,e为正极,燃料电池中CO作还原剂,在负极发生反应,电极反应为CO+4OH--2e-=CO32-+2H2O,所以通入CO的管口是d,故答案为:d;CO+4OH--2e-=CO32-+2HO.
(2)①利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol):1 3 0 0
变化(mol):0.75 2.25 0.75 0.75
平衡(mol):0.25 0.75 0.75 0.75
从反应开始到平衡,H2O的平均反应速率v(H2O)=
| ||
| 10min |
故答案为:0.0375 mol?L-1?min-1;
②A、因正反应放热,升高温度平衡向逆反应方向移动,故A错误;
B、将CH3OH(g)从体系中分离,平衡向正反应方法移动,故B正确;
C、催化剂不影响平衡移动,故C错误;
D、再充入1mol CO2和4mol H2,反应物浓度增大,平衡向正反应方向移动,故D正确;
故答案为:BD;
(3)①CO32-第一步水解的平衡常数
| KW |
| 5.61×10-11 |
| KW |
| 1.77×10-5 |
故答案为:碱;CO32-+H2O?HCO3-+OH-;
②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3?H2O),故A错误;
B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故B错误;
C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1 ,故C正确;
D.溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3?H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;
故答案为:CD;
(4)由图可知,氢氧根离子流向负极,则d为负极,e为正极,燃料电池中CO作还原剂,在负极发生反应,电极反应为CO+4OH--2e-=CO32-+2H2O,所以通入CO的管口是d,故答案为:d;CO+4OH--2e-=CO32-+2HO.
点评:本题综合性强、内容跨度大,涉及盖斯定律运用、化学反应速率计算、化学平衡移动、离子浓度大小比较、原电池反应等知识,考查了学生分析问题、解决问题的能力,题目难度较大.

练习册系列答案
相关题目
在下列各用途中,利用了物质的氧化性的是( )
| A、用食盐腌制食物 |
| B、用漂粉精消毒游泳池中的水 |
| C、用汽油洗涤衣物上的油污 |
| D、用盐酸除去铁钉表面的铁锈 |
下列实验操作不能达到预期目的是( )
A、 分离CH3COOC2H5和饱和碳酸钠溶液 |
B、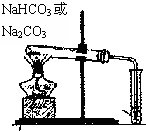 鉴别碳酸钠和碳酸氢钠 |
C、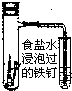 铁的吸氧腐蚀实验 |
D、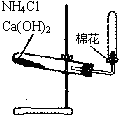 实验室制备氨气 |
下列说法正确的是( )
| A、塑化剂DEHP是指邻苯二甲酸二(2─乙基己)酯,对人体无害,可用作食品添加剂 |
| B、二氧化氮经过加压凝成无色液体为物理变化 |
| C、Na2O?SiO2是一种简单的硅酸盐,可溶于水 |
| D、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
下列反应所得溶液中只含一种溶质的是( )
| A、Fe2(SO4)3溶液中加入过量Fe粉 |
| B、A1(OH)3中加入过量NaOH溶液 |
| C、浓H2SO4中加入过量Cu片,加热 |
| D、Ca(C1O)2溶液中通入过量CO2 |
 、AlO
、AlO 、K+、S2-等离子
、K+、S2-等离子