题目内容
14.下列说法正确的是( )| A. | 向Na2S03溶液中加入硝酸酸化的BaCl2,有白色沉淀出现,说明Na2S03溶液已经变质 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 等体积、pH都为3的酸HCl和CH3COOH分别与足量的锌反应,放出的氢气一样多 | |
| D. | 硫酸铁可用于净水,因为三价铁离子可水解生成Fe(OH)3沉淀 |
分析 A、硝酸能将Na2S03氧化为Na2S04;
B、在原电池中,正极被保护;
C、醋酸是弱电解质,不能完全电离;
D、三价铁离子水解为氢氧化铁胶体.
解答 解:A、硝酸能将Na2S03氧化为Na2S04,故即使Na2S03没有变质,加入硝酸酸化的BaCl2后也会生成白色沉淀,故A错误;
B、在原电池中,正极被保护,当在船体上镶嵌锌块时,锌做负极,船体做正极被保护,故能减缓轮船的腐蚀,故B正确;
C、醋酸是弱电解质,不能完全电离,故等体积、pH都为3的酸HCl和CH3COOH,醋酸的浓度远大于盐酸,即醋酸的物质的量大于盐酸,则和足量的锌反应时,放出的氢气醋酸更多,故C错误;
D、三价铁离子水解为氢氧化铁胶体,而不是氢氧化铁沉淀,故D错误.
故选B.
点评 本题考查了金属腐蚀的防护、强弱电解质的区别和铁盐的净水,难度不大,注意基础的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A. | 海水中含有钾元素,仅通过物理变化就可以得到金属钾 | |
| B. | 海水各种化学资源的开发过程中,必须都要发生化学反应 | |
| C. | 从海水中可以得到MgCl2,电解熔融MgCl2,可制备Mg | |
| D. | 利用潮汐发电是将化学能转化为电能 |
5.下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的是( )
| A. | Na2CO3 | B. | Fe2O3 | C. | Al2O3 | D. | SiO2 |
2.同温同压下,等体积的两容器中分别充满14N16O和13C16O气体,下列对两容器中气体判断不正确的是( )
| A. | 原子数相同 | B. | 中子数相同 | C. | 质子数相同 | D. | 气体质量不相同 |
19.NM-3是处于临床试验阶段的小分子抗癌药物,分子结构如图.下列说法正确的是( )


| A. | 该有机物的化学式为C12H12O6 | |
| B. | 1mol该有机物最多可以和3molNaOH反应 | |
| C. | 该有机物容易发生加成、取代、消去等反应 | |
| D. | 该有机物可代替KSCN检验Fe3的存在 |
6. 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )
 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡.该反应中CO2的平衡转化率随温度的变化曲线如图所示.下列说法正确的是( )| A. | 反应2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)的△S<0、△H<0 | |
| B. | 表示乙容器CO2的平衡转化率随温度变化的是曲线B | |
| C. | 体系中c(CH3OCH3):c(CH3OCH3,状态Ⅱ)<2c(CH3OCH3,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)<v逆(状态Ⅲ) |
8.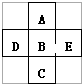 在元素周期表中前四周期的五种元素的位置关系如图所示.若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )
在元素周期表中前四周期的五种元素的位置关系如图所示.若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )
 在元素周期表中前四周期的五种元素的位置关系如图所示.若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )
在元素周期表中前四周期的五种元素的位置关系如图所示.若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )| A. | 5Z | B. | 5Z+18 | C. | 5Z+10 | D. | 5Z+8 |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
 HCO3-+OH-;
HCO3-+OH-;