题目内容
4.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )| A. | 海水中含有钾元素,仅通过物理变化就可以得到金属钾 | |
| B. | 海水各种化学资源的开发过程中,必须都要发生化学反应 | |
| C. | 从海水中可以得到MgCl2,电解熔融MgCl2,可制备Mg | |
| D. | 利用潮汐发电是将化学能转化为电能 |
分析 A.海水的钾以KCl存在,经电解可得到K;
B.海水中含有氯化钠,经过海水蒸发制得氯化钠,只发生了物理变化;
C.工业用电解熔融的氯化镁的方法冶炼镁;
D.利用朝汐发电是朝汐能转化为电能.
解答 解:A.海水的钾以KCl存在,经电解可得到K,属于化学变化,故A错误;
B.海水中含有氯化钠,经过海水蒸发制得氯化钠,只发生了物理变化,没有发生化学变化,故B错误;
C.镁为活泼金属,从海水中得到MgCl2后,可以电解熔融状态的MgCl2生成氯气和金属镁,故C正确;
D.利用朝汐发电是朝汐能转化为电能,没有发生化学反应,而化学能转化为电能必须要发生化学反应,故D错误;
故选C.
点评 本题考查化学变化、海水制盐原理、潮汐发电等,为高频考点,侧重于学生的双基的考查,难度不大,注意海水蒸发制海盐的过程中的物理变化,主要考查基本知识和基本反应原理,需要正确记忆并深化理解,才能从基本的知识着手,快速答题.

练习册系列答案
相关题目
14.下列物质不能用加成反应得到的是( )
| A. | CH2Cl2 | B. | CH3CH2Cl | C. | CH3CH2OH | D. |  |
15. 某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【-COO-基团与氢气不反应】
某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【-COO-基团与氢气不反应】
 某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【-COO-基团与氢气不反应】
某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【-COO-基团与氢气不反应】| A. | 化学式为(C11H11O2)n | |
| B. | 它能发生还原反应 | |
| C. | 它可以和FeCl3溶液发生显色反应 | |
| D. | 1mol该分子最多能和4molH2发生加成反应 |
12.优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2一乙烯吡啶(简写P2VP)和I2 的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为2Li+P2VP•nI2═P2VP•(n-1)I2+2LiI,则下列说法正确的是( )
| A. | 聚2一乙烯吡啶的复合物与有机物性质相似,因此聚2一乙烯吡啶的复合物不会导电 | |
| B. | 正极的反应为P2VP•nI2+2Li++2e-═P2VP•(n-1)I2+2LiI | |
| C. | 电池工作时,碘离子移向P2VP一极 | |
| D. | 该电池所产生的电压低,使用寿命比较短 |
19.下列微粒中,电子层结构完全相同的一组是( )
| A. | S2-、Cl-、K+ | B. | Cl-、Br-、I- | C. | Na+、Mg2+、Cl- | D. | O2-、Mg2+、Cl- |
9.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;化学性质最不活泼的元素是Ar.
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
16.2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德•埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )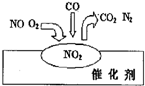

| A. | NO2是该过程的最终产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分是CO2和NO | |
| D. | 该催化转化的总反应方程式为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$ 4CO2+N2 |
13.在由水电离产生的c(H+)=1×10-14mol/L的无色溶液中,一定可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、SO42- | B. | K+、Cu2+、Cl-、NO3- | ||
| C. | NH4+、Al3+、Br-、SO42- | D. | Na+、Ba2+、Cl-、NO3- |
14.下列说法正确的是( )
| A. | 向Na2S03溶液中加入硝酸酸化的BaCl2,有白色沉淀出现,说明Na2S03溶液已经变质 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 等体积、pH都为3的酸HCl和CH3COOH分别与足量的锌反应,放出的氢气一样多 | |
| D. | 硫酸铁可用于净水,因为三价铁离子可水解生成Fe(OH)3沉淀 |