题目内容
8.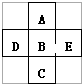 在元素周期表中前四周期的五种元素的位置关系如图所示.若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )
在元素周期表中前四周期的五种元素的位置关系如图所示.若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )| A. | 5Z | B. | 5Z+18 | C. | 5Z+10 | D. | 5Z+8 |
分析 由元素周期表中前四周期的五种元素的位置图可知,A位于第二周期,D、B、E位于第三周期,C位于第四周期,且位于周期表的右侧,以此来解答.
解答 解:由元素周期表中前四周期的五种元素的位置图可知,A位于第二周期,D、B、E位于第三周期,C位于第四周期,且位于周期表的右侧,B元素的核电荷数为Z,A的核电荷数为Z-8,D的为Z-1,E为Z+1,C的为Z+18,
则五种元素的核电荷数之和为Z+Z-8+Z-1+Z+1+Z+18=5Z+10,
故选C.
点评 本题考查元素的位置与结构,为高频考点,把握元素在周期表的位置、核电荷数的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 向Na2S03溶液中加入硝酸酸化的BaCl2,有白色沉淀出现,说明Na2S03溶液已经变质 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 等体积、pH都为3的酸HCl和CH3COOH分别与足量的锌反应,放出的氢气一样多 | |
| D. | 硫酸铁可用于净水,因为三价铁离子可水解生成Fe(OH)3沉淀 |
15.某淀粉胶体内混有盐酸和食盐,欲使胶体pH升高并除去食盐,可采用的方法是( )
| A. | 盐析 | B. | 萃取 | C. | 渗析 | D. | 蒸馏 |
12.下列反应属于放热反应的是( )
| A. | 稀盐酸与氢氧化钠反应 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | 煅烧石灰石制生石灰 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
3.氧元素和硫元素的本质区别是( )
| A. | 中子数不同 | B. | 质子数不同 | ||
| C. | 电子数不同 | D. | 相对原子质量不同 |
13.设NA表示阿伏加德罗常数的值,下列表述不正确的是( )
| A. | 1 mol•L-1 的硫酸钾溶液中K+数为2NA | |
| B. | 3.2g氧气所含的原子数为0.2NA | |
| C. | 标准状况下,22.4L氢气所含质子数是2NA | |
| D. | 常温常压下,32g O2和32g O3所含氧原子数都是2NA |
17.一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+C02(g)+2H20(g)△H=-574 kJ.mol-1
②CH4(g)+4NO(g)═2N2(g)+C02(g)+2H2O(g)△H=-1160kJ.mol-1
则下列选项中正确的是( )
①CH4(g)+4N02(g)═4NO(g)+C02(g)+2H20(g)△H=-574 kJ.mol-1
②CH4(g)+4NO(g)═2N2(g)+C02(g)+2H2O(g)△H=-1160kJ.mol-1
则下列选项中正确的是( )
| A. | CH4(g)+2N02(g)═N2(g)+C02(g)+2H2O(l)△H=-867 kJ.mol-1 | |
| B. | CH4催化还原1molNOx为N2的过程中,若x=1.5,则转移的电子总数为3×6.02×1021 | |
| C. | 若0.2 mol CH4还原N02至N2,在上述条件下吸收眵热迸为173.4 kJ | |
| D. | 若用4.48 LCH4还原N02至N2,整个过程中转移电子总数为1.6×6.02×1021 |
18.下列关于化学用语的表示正确的是( )
| A. | 乙醇的结构简式:C2H6O | B. | 丙烷分子的球棍模型示意图: | ||
| C. | 芳香烃的组成通式:CnH2n-6(n≥6) | D. | 乙炔的最简式:CH≡CH |