题目内容
10.铁、锌、镍、铬及其合金在现代社会中的用途越来越广泛.(1)铁在元素周期表中的位置是第四周期Ⅶ族,基态铁原子有26种不同运动状态的电子.
(2)镍可与CO形成配合物Ni(CO)n,CO分子中σ键与π键的个数比为1:2;该配合物中原子Ni的价层电子总数为18,则n=4,该配合物的熔点是170℃,则Ni(CO)n 属于分子
(3)在铬的摧化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是
sp2和sp3,乙醛分子中H-C=O的键角大于(填“大于”、“等于”或“小于”)乙醇分子中的H-C-O的键角.乙醇和乙醛均极易溶于水,其主要原因是乙醛、乙醇均能与水形成分子间氢键.
(4)立方NiO晶体结构类似于NaCl,则Ni2+填入O2-构成的正八面体空隙(填“正四面体”、“正八面体”、“立方体”或“压扁八面体”).其晶胞边长为ɑ pm,列式表示NiO晶体的密度为$\frac{300}{{N}_{A}•{a}^{3}}×1{0}^{30}$g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)
分析 (1)周期表中的位置:电子层数等于周期序数,族序数看价电子,如果d轨道没有价电子就是主族元素,有几个价电子就是第几主族,如果d轨道上有价电子就是副族元素,价电子有几个就是第几副族,如果价电子为8、9或者10个就都是第Ⅷ族,价电子d轨道上是10个电子,s轨道上有几个电子就是第几副族;核外电子的运动状态各不相同,因此核外有多少电子就有多少不同运动状态的电子;
(2)CO分子与N2互为等电子体,CO结构式为C≡O,共价单键是σ键,共价双键中一个是σ键,一个是π键;价电子总数(18)=Ni的价电子数(10)+CO提供电子数(n×2),Ni(CO)n的熔点是170℃,熔点低,则该化合物属于分子晶体;
(3)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;碳原子杂化方式不同导致其键角不同;氢键影响物质的溶解性;
(4)立方NiO晶体结构类似于NaCl,则Ni2+填入O2-构成的正八面体,根据均摊法计算晶胞中Ni、O原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)铁核外电子数为26,各电子层电子数为2、8、14、2,原子基态时的核外电子排布式为1s22s22p63s23p63d64s2,所以位于第四周期第VIII族,基态铁原子核外电子数为26,有26种不同运动状态的电子,
故答案为:第四周期Ⅶ族;26;
(2)CO分子与N2互为等电子体,CO结构式为C≡O,CO分子中σ键与π键的个数比为1:2,该配合物中原子Ni的价层电子总数为18,价电子总数(18)=Ni的价电子数(10)+CO提供电子数(n×2),n=4,Ni(CO)n的熔点是170℃,熔点低,则该化合物属于分子晶体,
故答案为:1:2;4;分子;
(3)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,乙醛、乙醇均能与水形成分子间氢键,所以乙醇和乙醛均极易溶于水,
故答案为:sp2和sp3;大于;乙醛、乙醇均能与水形成分子间氢键;
(4)Na+填入Cl-构成的正八面体,则Ni2+填入O2-构成的正八面体,晶胞中Ni原子数目为1+12×$\frac{1}{4}$=4,氧原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{59+16}{{N}_{A}}$g,晶胞边长为apm,晶胞体积为(a×10-10 cm)3,NiO晶体的密度为ρ=$\frac{m}{V}$=$\frac{300}{{N}_{A}•{a}^{3}}×1{0}^{30}$,
故答案为:正八面体;$\frac{300}{{N}_{A}•{a}^{3}}×1{0}^{30}$.
点评 本题考查了物质结构和性质,涉及核外电子排布、化学键、杂化轨道、氢键、晶胞计算等,为高频考点,利用构造原理写出基态该原子核外电子排布,注意利用均摊法计算晶胞质量,(4)为该题难点,题目难度中等.

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 微粒半径:Li+<O2-<F-<Na+ | B. | 电负性:F>N>O>C | ||
| C. | 分子中的键角:CO2>H2O>CH4>NH3 | D. | 共价键的键能:H-F>H-Cl>H-Br>H-I |
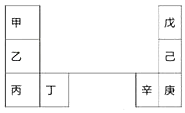 甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差11 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$;△H<0(选填“>”、“<”或“=”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若测得反应初始至6S内A的平均反应速率v(A)=0.002mol•L-1•S-1,则6S时c(A)=0.028 mol•L-1;C的物质的量为0.06mol.
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为80%;保持温度、容器不变,再向密闭容器中充入0.20mol的A和0.80mol的B,此时A的转化率为80%;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率不变(选填“增大”、“减小”、“不变”).
(4)判断该反应是否达到平衡的依据为ce(填正确选项的字母).
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
e.单位时间内生成amolA的同时,消耗amolB
(5)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
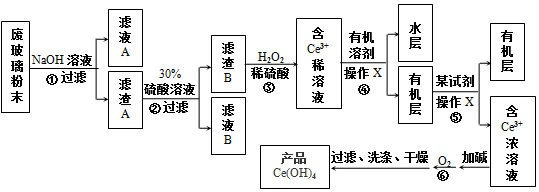
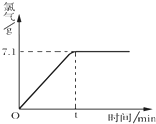 氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:
氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算: