题目内容
20.高温下铁和水蒸气发生反应,生成1.12L气体(标准状况下),相同质量的铁放入某浓度250mL稀盐酸中恰好反应.计算(1)参加反应的铁的质量;
(2)盐酸溶液的物质的量浓度.
分析 (1)Fe与水蒸气反应生成四氧化三铁和氢气,发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol;
(2)发生Fe+2HCl=FeCl2+H2↑,结合c=$\frac{n}{V}$计算.
解答 解:(1)n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,由3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2可知,参加反应的铁为0.05mol×$\frac{3}{4}$×56g/mol=2.1g,
答:参加反应的铁的质量为2.1g;
(2)n(Fe)=0.05mol×$\frac{3}{4}$=0.0375mol,由Fe+2HCl=FeCl2+H2↑可知,n(HCl)=0.0375mol×2=0.075mol,c(HCl)=$\frac{0.075mol}{0.25L}$=0.3mol/L,
答:盐酸溶液的物质的量浓度为0.3mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意Fe与水蒸气生成四氧化三铁,题目难度不大.

练习册系列答案
相关题目
11.手性化合物一般是指含手性碳原子的化合物,手性碳原子是指连接有四个不同的原子或原子团的碳原子.化合物CH3-CH2-CH(OH)-CH=CH2中含有一个手性碳原子,则下列变化中不能使该手性化合物的手性消失的是( )
| A. | 氧化反应 | B. | 取代反应 | C. | 加成反应 | D. | 消去反应 |
15.下列有关物质的性质与用途具有对应关系的是( )
| 性质 | 用途 | |
| A | 液氨气化吸热 | 可用作制冷剂 |
| B | NH4HCO3受热易分解 | 可用作氮肥 |
| C | 二氧化硅能与HF反应 | 可用作光导纤维 |
| D | 二氧化硫能使溴水褪色 | 可用作漂白剂 |
| A. | A | B. | B | C. | C | D. | D |
5.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
12.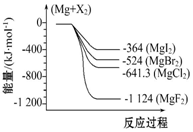 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )| A. | Mg与F2反应放热最多 | |
| B. | MgF2(s)+Br2(l)═MgBr2(s)+F2(g)吸热 | |
| C. | MgBr2与Cl2反应放热 | |
| D. | 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2 |
9. 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质.
①写出该反应的化学反应方程式:4NH3+6NO=5N2+6H2O.
②已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1.105℃时,则上述脱硝反应的△H=-1811.63kJ•mol-1,该反应能(填“能”“否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为3:2.每生成1mol还原产物,则反应中转移电子数为4mol.
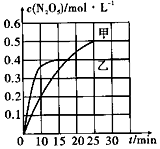
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)?N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
①0~10min内甲容器中反应的平均速率:v(O3)=mol•L-1•min-1.
②T1<T2(填“>”“<”或“=”),T1时,该反应的平衡常数为0.5L•mol-1.
③下列措施能提高容器乙中NO2转化率的是D (填序号).
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,
v(正)<v(逆) (填“>”“<”“=”).
 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质.
①写出该反应的化学反应方程式:4NH3+6NO=5N2+6H2O.
②已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1.105℃时,则上述脱硝反应的△H=-1811.63kJ•mol-1,该反应能(填“能”“否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为3:2.每生成1mol还原产物,则反应中转移电子数为4mol.
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)?N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
②T1<T2(填“>”“<”或“=”),T1时,该反应的平衡常数为0.5L•mol-1.
③下列措施能提高容器乙中NO2转化率的是D (填序号).
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,
v(正)<v(逆) (填“>”“<”“=”).
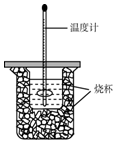 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题: