题目内容
7.在Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2的反应中,Fe3O4是氧化剂,CO是还原剂,C元素被氧化,CO2是氧化产物.分析 化合价降低元素所在的反应物是氧化剂,该元素被还原,化合价升高元素所在的反应物是还原剂,该元素被氧化.
解答 解:在Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2的反应中,铁元素的化合价降低,所以铁元素被还原,Fe3O4是氧化剂,碳元素化合价升高,所以碳元素被氧化,CO是还原剂,生成CO2是氧化产物,故答案为:Fe3O4;CO;C;CO2.
点评 本题考查学生氧化还原反应中的基本概念,抓住化合价变化即可解答,较简单.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
17.下列实验操作或装置正确的是( )

| A. | ①分离出BaSO4浊液中的BaSO4 | |
| B. | ②除去CO2中少量HCl气体 | |
| C. | ③配制一定物质的量浓度溶液时转移溶液 | |
| D. | ④制取一定量的CO2 |
15.下列变化中,属于还原反应的是( )
| A. | H+→H2O | B. | SO3→H2SO4 | C. | Fe2+→Fe3+ | D. | Cl2→Cl- |
2.下列离子方程式正确的是( )
| A. | 硝酸银溶液与铜:Cu+Ag+=Cu2++Ag | |
| B. | 氧化铜与盐酸反应:O2-+2H+=H2O | |
| C. | 硫酸氢钠与氢氧化钠溶液混合:OH-+H+=H2O | |
| D. | 向澄清石灰水中加入盐酸:2H++Ca(OH)2=Ca2++2H2O |
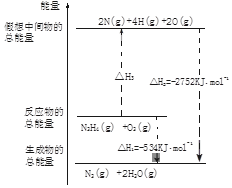 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.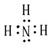 .
. ,水玻璃可用作木材防火剂,其主要成分是(写化学式)Na2SiO3.写出工业生产粗硅的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.高温条件下,二氧化硅、碳粉、氮气以物质的量之比3:6:2反应可以生成氮化硅陶瓷(一种新型无机非金属材料,具有耐高温、耐磨、抗氧化等特性)和另一种气体化合物,该反应的化学方程式为3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
,水玻璃可用作木材防火剂,其主要成分是(写化学式)Na2SiO3.写出工业生产粗硅的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.高温条件下,二氧化硅、碳粉、氮气以物质的量之比3:6:2反应可以生成氮化硅陶瓷(一种新型无机非金属材料,具有耐高温、耐磨、抗氧化等特性)和另一种气体化合物,该反应的化学方程式为3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.