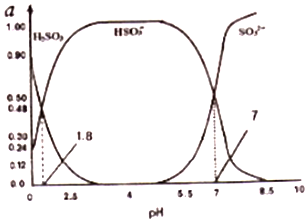
题目内容
2.下列离子方程式正确的是( )| A. | 硝酸银溶液与铜:Cu+Ag+=Cu2++Ag | |
| B. | 氧化铜与盐酸反应:O2-+2H+=H2O | |
| C. | 硫酸氢钠与氢氧化钠溶液混合:OH-+H+=H2O | |
| D. | 向澄清石灰水中加入盐酸:2H++Ca(OH)2=Ca2++2H2O |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.氧化铜为难溶物,离子方程式中氧化铜不能拆开;
C.硫酸氢钠与氢氧化钠溶液发生反应生成硫酸钠和水;
D.澄清石灰水中的氢氧化钙应该拆开.
解答 解:A.硝酸银溶液与铜发生置换反应,正确的离子方程式为:Cu+2Ag+=Cu2++2Ag,故A错误;
B.氧化铜与盐酸反应生成氯化铜和水,氧化铜需要保留化学式,正确的离子方程式为:CuO+2H+=H2O+Cu2+,故B错误;
C.硫酸氢钠与氢氧化钠溶液混合,反应生成硫酸钠和水,反应的离子方程式为:OH-+H+=H2O,故C正确;
D.向澄清石灰水中加入盐酸,二者反应生成氯化钙和水,氢氧化钙应该拆开,正确的离子方程式为:OH-+H+=H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将NaHCO3固体加入新制氯水中,有无色气泡(H+) | |
| B. | 新制氯水呈黄绿色(Cl2) | |
| C. | 使蓝色石蕊试纸先变红后褪色(H+、Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
10.某溶液中有Fe2+、NH4+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目维持不变的阳离子是( )
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Fe3+ |
17.在常温下,分别利用下列反应产生氢气,其反应方程式分别为:
①2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O
②KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O
如果上述两个反应所产生的氯气质量相等,被氧化的还原剂的物质的量之比为( )
①2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O
②KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O
如果上述两个反应所产生的氯气质量相等,被氧化的还原剂的物质的量之比为( )
| A. | 8:5 | B. | 6:5 | C. | 2:1 | D. | 1:1 |
14.实验时研究化学的基础,图中所示的实验操作正确的是:实验时研究化学的基础,图中所示的实验操作正确的是:( )
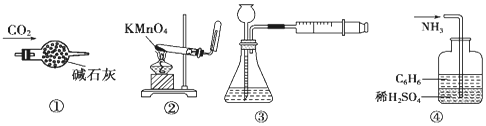

| A. | 装置①:干燥CO2 | B. | 装置②:实验室制取并收集O2 | ||
| C. | 装置③:装置气密性的检查 | D. | 装置④:吸收NH3 |
11.在一定温度下,向aL密闭的容器中加入1 molX气体和1 molY气体,发生如下反应:X(g)+Y(g)?2Z(g)此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内各物质X、Y、Z的浓度之比为1:1:2 | |
| D. | 单位时间内消耗0.1 molX,同时生成0.2 molZ |
4.下列有关物质的性质和用途的说法正确的是( )
| A. | 一定条件下,用秸秆可制得葡萄糖和酒精 | |
| B. | 铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁的稳定 | |
| C. | 氧气被用作火箭的燃料,利用了氧气的可燃性 | |
| D. | 稀有气体充入霓虹灯,利用了稀有气体通电时发出不同颜色的光的化学性质 |