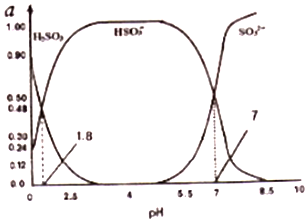
题目内容
18.下列说法正确的是( )①Na2O2中阴、阳离子的个数比是1:1 ②Na2O2分别与水及CO2反应产生等量氧气时,消耗水和CO2的物质的量相等 ③可用石英坩埚加热氢氧化钠固体 ④Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色 ⑤区别NaHCO3与Na2CO3溶液,Ca(OH)2溶液和CaCl2溶液均可用 ⑥NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火 ⑦NaHCO3粉末中混有Na2CO3,可配置成溶液通入过量的CO2,再低温结晶得到提纯.
| A. | ②③④ | B. | ②⑤⑦ | C. | ②④⑦ | D. | ③④⑥ |
分析 ①Na2O2中阴离子是过氧根离子、阳离子是钠离子,所以阴、阳离子的个数比是2:1;
②反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,以此解答;
③二氧化硅与氢氧化钠反应生成硅酸钠;
④Na2O2投入到紫色石蕊试液中,与水反应生成氢氧化钠成碱性所以溶液先变蓝,又因为过氧化钠具有强氧化性而有漂白性;
⑤NaHCO3与Na2CO3溶液都与氢氧化钙溶液反应生成沉淀;
⑥NaHCO3不稳定,加热易分解,钠着火时不能用二氧化碳扑灭;
⑦Na2CO3可与过量的CO2反应生成NaHCO3.
解答 解:①Na2O2中阴离子是过氧根离子、阳离子是钠离子,所以阴、阳离子的个数比是2:1,而不是1:1,故错误;
②反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,生成1mol的氧气消耗二氧化碳和水的物质的量都为2mol,故正确;
③二氧化硅与氢氧化钠反应生成硅酸钠,所以不能用石英坩埚加热氢氧化钠固体,故错误;
④Na2O2投入到紫色石蕊试液中,与水反应生成氢氧化钠成碱性所以溶液先变蓝,又因为过氧化钠具有强氧化性而有漂白性,所以后褪色,故正确;
⑤NaHCO3与Na2CO3溶液都与氢氧化钙溶液反应生成沉淀,应用氯化钙鉴别,故错误;
⑥NaHCO3不稳定,加热易分解,钠着火时生成过氧化钠,可与二氧化碳反应生成氧气,则不能用二氧化碳扑灭,故错误;
⑦Na2CO3可与过量的CO2反应生成NaHCO3,可用于除杂,故正确;
故选:C.
点评 本题考查过氧化钠的性质,为高考高频考点,侧重于学生的分析能基础知识的综合运用,注意把握反应的化学方程式,根据方程式可解答该题,难度不大.

练习册系列答案
相关题目
8.联氨(N2H4)是一种应用广泛的化工原料,可用作火箭燃料.已知:
①N2H4(l)+$\frac{1}{2}$N2O4(l)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-546.45kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
则2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) 的△H是( )
①N2H4(l)+$\frac{1}{2}$N2O4(l)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-546.45kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
则2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) 的△H是( )
| A. | -916.9 kJ/mol | B. | -458.45 kJ/mol | C. | +916.9 kJ/mol | D. | +458.45 kJ/mol |
9.下列说法不正确的是( )
| A. | 在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| C. | 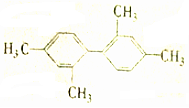 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 聚合物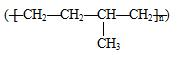 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
6.甲烷的燃烧热为△H1,氢气的燃烧热为△H2,且△Hl<△H2,若甲烷和氢气的混合物1mol完全燃烧生成稳定的化合物时,反应热为△H3,则甲烷和氢气的物质的量之比为( )
| A. | $\frac{△{H}_{3-}△{H}_{2}}{△{H}_{3-}△{H}_{2}}$ | B. | $\frac{△{H}_{2-}△{H}_{3}}{△{H}_{3-}△{H}_{1}}$ | ||
| C. | $\frac{△{H}_{2}-△{H}_{3}}{△{H}_{1}-△{H}_{3}}$ | D. | $\frac{△{H}_{3}-△{H}_{1}}{△{H}_{2}-△{H}_{3}}$ |
10.某溶液中有Fe2+、NH4+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目维持不变的阳离子是( )
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Fe3+ |