题目内容
9.铁、铝、硅及其化合物在生产、生活中有广泛的用途.试回答下列问题:(1)常用作红色油漆和涂料的铁的氧化物是Fe2O3 (写化学式).将少量该氧化物溶于稀盐酸中,并滴加几滴KSCN溶液,再加入过量的铁粉,振荡,这时看到的现象是红色褪去.
(2)“铝粉”的俗称为“银粉”,皆因铝粉色泽如银.“银粉”质轻,遇明火即炸,写出反应的化学方程式4Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3.“银粉”与烧碱溶液反应的离子方程式为2Al+2OH-+2H2O=+2AlO2-+3H2↑.
(3)硅的原子结构示意图为
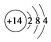 ,水玻璃可用作木材防火剂,其主要成分是(写化学式)Na2SiO3.写出工业生产粗硅的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.高温条件下,二氧化硅、碳粉、氮气以物质的量之比3:6:2反应可以生成氮化硅陶瓷(一种新型无机非金属材料,具有耐高温、耐磨、抗氧化等特性)和另一种气体化合物,该反应的化学方程式为3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
,水玻璃可用作木材防火剂,其主要成分是(写化学式)Na2SiO3.写出工业生产粗硅的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.高温条件下,二氧化硅、碳粉、氮气以物质的量之比3:6:2反应可以生成氮化硅陶瓷(一种新型无机非金属材料,具有耐高温、耐磨、抗氧化等特性)和另一种气体化合物,该反应的化学方程式为3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
分析 (1)氧化铁俗称铁红,是一种红棕色的物质;三价铁离子遇硫氰酸根离子显红色,铁能还原铁离子;
(2)“银粉”质轻,遇明火即炸,为铝和氧气的反应Al和氧气反应生成氧化铝,铝与烧碱反应生成偏铝酸钠和氢气;
(3)原子结构示意图书写:圆内数字为原子的质子数,符号表示电性,圆外的弧线为电子层,弧线上的数字为该层上的电子数,离圆最近的弧线表示第一层,依次向外为第二层、第三层等,据此书写硅原子的原子结构示意图;水玻璃为硅酸钠的水溶液,工业生产粗硅,C与二氧化硅反应生成Si和CO;氮化硅化学式为Si3N4,氮气可防止氧气氧化氮化硅,二氧化硅、碳、氮气以物质的量之比3:6:2反应生成两种化合物,生成氮化硅和一氧化碳.
解答 解:(1)氧化铁俗称铁红,是一种红棕色的物质,常用作红色油漆和涂料,化学式为:Fe2O3 ,将少量该氧化物溶于稀盐酸中,Fe2O3+6HCl═2FeCl3+3H2O,并滴加几滴KSCN溶液,Fe3++3SCN-=Fe(SCN)3,溶液后变成红色,加入Fe粉反应为:Fe+2Fe3+═3Fe2+,此时溶液红色褪去,
故答案为:Fe2O3 ;红色褪去;
(2)“银粉”质轻,遇明火即炸,为铝和氧气的反应:4Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3,Al与烧碱反应生成偏铝酸钠和氢气,反应为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,离子方程式为2Al+2OH-+2H2O=+2AlO2-+3H2↑,
故答案为:4Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3;2Al+2OH-+2H2O=+2AlO2-+3H2↑;
(3)硅原子的质子数为14,有3个电子层,第一电子层容纳2个电子,第二电子层容纳8个电子,最外层容纳4个电子,原子结构示意图为: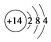 ,水玻璃是Na2SiO3的水溶液,工业生产粗硅,C与二氧化硅反应生成Si和CO,化学反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,二氧化硅、碳、氮气以物质的量之比3:6:2反应生成两种化合物,生成氮化硅和一氧化碳,反应的化学方程式为:3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,
,水玻璃是Na2SiO3的水溶液,工业生产粗硅,C与二氧化硅反应生成Si和CO,化学反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,二氧化硅、碳、氮气以物质的量之比3:6:2反应生成两种化合物,生成氮化硅和一氧化碳,反应的化学方程式为:3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,
故答案为: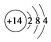 ;Na2SiO3;SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
;Na2SiO3;SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;3SiO2+2N2+6C $\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
点评 本题考查元素化合物知识,涉及化学反应方程式及离子反应方程式的书写,为高频考点,掌握铁、铝、硅及其化合物知识为解答的关键,题目难度中等.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案| A. | 肯定不含 I- | B. | 肯定不含 SO42- | C. | 可能含有 SO32- | D. | 肯定含有 NH4+ |
| A. | 一定条件下,用秸秆可制得葡萄糖和酒精 | |
| B. | 铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁的稳定 | |
| C. | 氧气被用作火箭的燃料,利用了氧气的可燃性 | |
| D. | 稀有气体充入霓虹灯,利用了稀有气体通电时发出不同颜色的光的化学性质 |
| A. | 有化学键断裂或化学键形成的过程都是化学变化 | |
| B. | Na2O2和Na2O都属于碱性氧化物 | |
| C. | 溶液中的溶质粒子能透过滤纸,而胶体中的分散质粒子不能透过滤纸,所以可以用滤纸来分离溶液和胶体 | |
| D. | 食盐溶液能导电,但食盐溶液不是电解质 |
N2(g)+3H2(g)?2NH3(g)△H=一92.4KJ•mol-1
(1)已知H2(g)的燃烧热为285KJ/mol,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式.
(2)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将逆向(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为$\frac{a}{100V}$mol•L-1.(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5)
(3)工业上常通过如下反应合成尿素[CO(NH2)2]:
CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变;则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
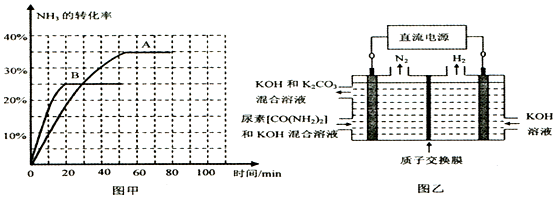
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O,若两极共收集到气体22.4L(标况),则消耗的尿素为15g(忽略气体的溶解).
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:A->B->C->D- | ||
| C. | 2A-+D2═2D-+A2反应不可以进行 | D. | 2C-+B2═2B-+C2反应能进行 |
| A. | pH=l的溶液:Ba2+、Al3+、Cl-、SO42- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、I- | |
| C. | c(OH-)/c(H+)=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 含有0.1mol/LFe(NO3)2的溶液:H+、Mg2+、SCN-、SO42- |