题目内容
15.下列变化中,属于还原反应的是( )| A. | H+→H2O | B. | SO3→H2SO4 | C. | Fe2+→Fe3+ | D. | Cl2→Cl- |
分析 属于还原反应,物质所含元素在反应中化合价应降低,被还原,以此解答该题.
解答 解:A.元素化合价没有发生变化,不是氧化还原反应,故A错误;
B.元素化合价没有发生变化,不是氧化还原反应,故B错误;
C.Fe元素化合价升高,被氧化,发生氧化反应,故C错误;
D.Cl2→Cl-,Cl元素化合价降低,被还原,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意加强相关概念的理解,难度不大.

练习册系列答案
相关题目
6.甲烷的燃烧热为△H1,氢气的燃烧热为△H2,且△Hl<△H2,若甲烷和氢气的混合物1mol完全燃烧生成稳定的化合物时,反应热为△H3,则甲烷和氢气的物质的量之比为( )
| A. | $\frac{△{H}_{3-}△{H}_{2}}{△{H}_{3-}△{H}_{2}}$ | B. | $\frac{△{H}_{2-}△{H}_{3}}{△{H}_{3-}△{H}_{1}}$ | ||
| C. | $\frac{△{H}_{2}-△{H}_{3}}{△{H}_{1}-△{H}_{3}}$ | D. | $\frac{△{H}_{3}-△{H}_{1}}{△{H}_{2}-△{H}_{3}}$ |
10.某溶液中有Fe2+、NH4+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目维持不变的阳离子是( )
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Fe3+ |
20.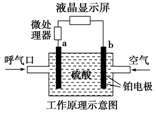 酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
 酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )| A. | b为正极,电极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解质溶液中的H+移向a电极 | |
| C. | 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 | |
| D. | 呼出气体中酒精含量越高,微处理器中通过的电流越小 |
17.已知:SO32-+I2+H2O═SO42-+2I-+2H+.某溶液中可能含有 Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( )
| A. | 肯定不含 I- | B. | 肯定不含 SO42- | C. | 可能含有 SO32- | D. | 肯定含有 NH4+ |