题目内容
19. 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.(1)NH3的电子式为
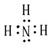 .
.(2)N2H4中N原子可达到8电子稳定结构,N2H4分子中含有的化学键是极性键、非极性键.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O.
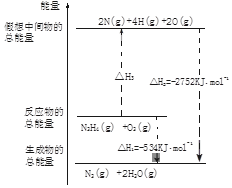
(4)肼是一种高能燃料,有关化学反应的能量变化如图所示:
已知断裂1mol化学键所需的能量(kJ):N≡N为942,O=O为500,N-N为154,则断裂1molN-H键所需的能量是391kJ.
(5)肼可做为火箭发动机的燃料,于氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)═N2O4(l)△H1═ -19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
分析 (1)氨气是共价化合物,氮原子最外层5个电子,和三个氢原子形成三个共价键,还有一对电子未成键,据此书写电子式;
(2)氮原子最外层电子数为3,易形成3个共价键分析形成8电子结构,不同原子间形成的共价键为非极性键,相同原子间形成的共价键为极性键;
(3)NH3与NaClO反应可得到肼(N2H4),氮元素化合价升高被氧化,次氯酸钠做氧化剂被还原为氯化钠,结合氧化还原反应电子守恒分析判断产物和配平化学方程式;
(4)图象分析反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到;
(5)已知:①N2(g)+2O2(g)═N2O4(l)△H1═ -19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2═-534.2kJ•mol-1
利用盖斯定律将②×2-①可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),并以此计算反应热.
解答 解:(1)氨气是共价化合物,氮原子最外层5个电子,和三个氢原子形成三个共价键,还有一对电子未成键,氨气分子的电子式为: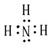 ,
,
故答案为: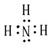 ;
;
(2)N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键,结构式为: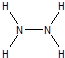 ,分子中含有非极性键和极性键,
,分子中含有非极性键和极性键,
故答案为:极性键、非极性键;
(3)NH3与NaClO反应可得到肼(N2H4),氮元素化合价升高被氧化,次氯酸钠做氧化剂被还原为氯化钠,依据原子守恒配平写出化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(4)依据图象分析,反应过程中化学键的变化和焓变的关系是,焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,反应为N2H4+O2=N2+2H2O,图象可知,反应的焓变△H=-534KJ/mol,断裂化学键吸收的能量=2752-534=2218,设断裂1molN-H键吸收的能量为x,4x+154+500=△H3=2752-534,x=391,
故答案为:391;
(5)已知:①N2(g)+2O2(g)═N2O4(l)△H1═ -19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2═-534.2kJ•mol-1
利用盖斯定律将②×2-①可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),△H=(-534.2kJ/mol)×2-(+19.5kJ/mol)=-1048.9kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
点评 本题考查了物质性质和结构的分析判断、原电池原理的应用、图象分析、焓变和盖斯定律计算、化学键能的计算关系应用,题目难度中等.

| A. | 在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| C. | 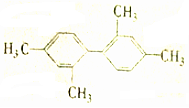 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 聚合物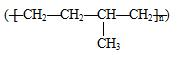 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Fe3+ |
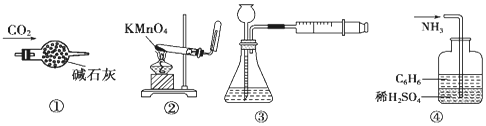
| A. | 装置①:干燥CO2 | B. | 装置②:实验室制取并收集O2 | ||
| C. | 装置③:装置气密性的检查 | D. | 装置④:吸收NH3 |
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内各物质X、Y、Z的浓度之比为1:1:2 | |
| D. | 单位时间内消耗0.1 molX,同时生成0.2 molZ |
N2(g)+3H2(g)?2NH3(g)△H=一92.4KJ•mol-1
(1)已知H2(g)的燃烧热为285KJ/mol,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式.
(2)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将逆向(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为$\frac{a}{100V}$mol•L-1.(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5)
(3)工业上常通过如下反应合成尿素[CO(NH2)2]:
CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变;则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
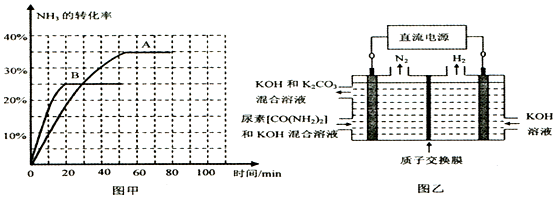
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O,若两极共收集到气体22.4L(标况),则消耗的尿素为15g(忽略气体的溶解).