题目内容
7.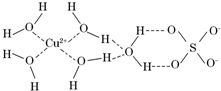 第四周期的许多金属能形成配合物.科学家通过X射线测得胆矾结构示意图可简单表示如下:
第四周期的许多金属能形成配合物.科学家通过X射线测得胆矾结构示意图可简单表示如下:(1)Cu基态原子的外围电子排布为3d104s1,Cr基态原子的外围电子排布为3d54s1,这样排布的理由是3d轨道全满或半满能量低较稳定.
(2)NH3是一种很好的配体,原因是氮原子有一对孤电子对.
(3)图中虚线表示的作用力为氢键、配位键.
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4•H2O晶体.在该晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO42-、H2O,其中[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是SO42一,写出一种与此正四面体结构互为等电子体的分子的分子式CCl4.
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型.Ni(CO)4易溶于BC(填标号).
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液.
分析 (1)Cu基态原子的外围电子排布为3d104s1;根据核外电子排布式的1s22s22p63s23p63d54s1,所以Cr基态原子的外围电子排布为3d54s1;根据能量最低原理及洪特规则书写其核外电子排布式,3d能级的能量大于4s能级的能量,所以先排4s后排3d,轨道中的电子处于全满、半满、全空时原子最稳定;
(2)NH3分子中氮原子有一对孤电子对,易形成配位键;
(3)电子对给予-接受键被称为配位键;氢键是由已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力,根据定义判断;(4)根据价层电子对互斥理论分析;结合等电子体的定义判断;
(5)根据相似相溶原理分析.
解答 解:(1)Cu基态原子的外围电子排布为3d104s1;根据核外电子排布式的1s22s22p63s23p63d54s1,所以Cr基态原子的外围电子排布为3d54s1;根据能量最低原理及洪特规则书写其核外电子排布式,3d能级的能量大于4s能级的能量,所以先排4s后排3d,轨道中的电子处于全满、半满、全空时原子最稳定,故答案为:3d104s1;3d54s1;3d轨道全满或半满能量低较稳定;
(2)NH3分子中氮原子有一对孤电子对,易形成配位键,故答案为:氮原子有一对孤电子对;
(3)通过图象知,图中虚线表示的作用力有铜离子和水分子之间的配位键,氢原子和另一分子中氧原子之间的氢键,故答案为:氢键、配位键;
(4)SO42一离子中含有4个δ键,孤电子对数=$\frac{6+2-4×2}{2}$=0,所以SO42一为正四面体结构,离子含有5的原子,价电子总数为32,对应的等电子体有CCl4、CF4;故答案为:SO42一;CCl4;
(5)呈正四面体构型,是对称结构,所以是非极性物质,根据相似相溶原理知,Ni(CO)4 易溶于非极性溶剂,苯、四氯化碳是非极性物质,所以Ni(CO)4 易溶于苯、四氯化碳,故答案为:BC.
点评 本题较为综合,突出考查配合物知识、核外电子排布、等电子体、氢键、相似相溶原理等问题,综合性较强,全面考查物质的结构和性质,题目难度较大.

 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )| A. | SO2(NaHSO3溶液) 无色喷泉 | B. | NH3(H2O含酚酞) 红色喷泉 | ||
| C. | H2S(CuSO4溶液) 黑色喷泉 | D. | HCl(AgNO3溶液) 白色喷泉 |
| A. | CH3-CH=CH2和CH3-CH2-CH=CH2 | B. | CH3-CH3和CH3-CH=CH2 | ||
| C. | CH3-CH2-CH3和CH3-CH=CH2 | D. | CH3-CH2-CH2-CH3和CH3-CH2-CHCl2 |

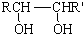 $→_{△}^{HIO_{4}}$ RCHO+R′CHO
$→_{△}^{HIO_{4}}$ RCHO+R′CHO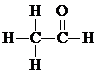 .
.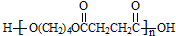 .
.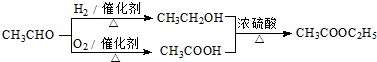
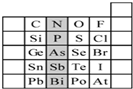 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空: