题目内容
7.(Ⅰ)如图1所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题: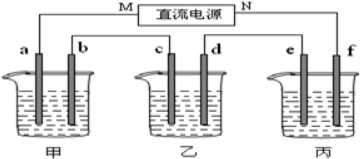
(1)电源的N端为负极;
(2)电极b上发生的电极反应为2H++2e?=H2↑;
(3)电极c上生成的气体在标准状态下的体积:0.112L;
(4)甲溶液的氢氧根离子浓度为0.1mol/L(设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为ZnCl2f电极的电极反应式为Zn2++2e-=Zn
(Ⅱ)依据反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图甲所示.
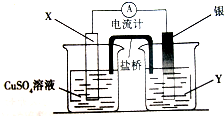
①电极X的材料是Cu
②在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是Cl-(填离子符号)
分析 I.测得乙中d电极质量增加了2.16g,则d电极发生Ag++e-=Ag,所以d电极为阴极,N为电源的负极,乙中阳极为c,发生4OH--4e-=2H2O+O2↑,甲中b为阴极,发生2H++2e?=H2↑,a为阳极,阳极上氢氧根离子失电子生成氧气;并结合电镀原理及电子守恒计算解答.
II.根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,原电池中,阴离子向负极移动,由此分析解答.
解答 解:I.(1)测得乙中d电极质量增加了2.16g,则d电极发生Ag++e-=Ag,所以d电极为阴极,N为电源的负极,故答案为:负;
(2)电解食盐水,b为阴极,发生2H++2e?=H2↑,故答案为:2H++2e?=H2↑;
(3)乙中d电极质量增加了2.16g,为银的质量,其物质的量为0.02mol,则转移电子为0.02mol,c电极上发生4OH--4e-=2H2O+O2↑,由电子守恒可知4Ag~O2↑,则气体的体积为0.02mol×$\frac{1}{4}$×22.4L/mol=0.112L,
故答案为:0.112L;
(4)由电子守恒可知2NaOH~2e-~2Ag,n(NaOH)=n(Ag)=0.02mol,则c(NaOH)=$\frac{0.02mol}{0.2L}$=0.1mol/L,故答案为:0.1mol/L;
(5)丙烧杯中实现铁的表面镀上一层锌,则电解质溶液为ZnCl2,e为Zn,f电极为阴极,其电极反应式为Zn2++2e-=Zn,
故答案为:ZnCl2;Zn2++2e-=Zn;
II.①由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,电极X的材料是Cu,
故答案为:Cu;
②盐桥中装有含琼胶的KNCl饱和溶液,则盐桥中Cl-移向负极,即Cl-向Cu(NO3)2溶液移动,故答案为:Cl-.
点评 本题考查电解原理、原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,明确惰性电极电解时离子的放电顺序及发生的电极反应即可解答,注意转移的电子守恒计算,题目难度中等.

| A. | 加热胆矾失去结晶水的过程称风化 | |
| B. | 在饱和溶液中,溶质溶解的速率等于结晶速率 | |
| C. | 原电池是把电能转化为化学能的装置 | |
| D. | 电能是二次能源 |
| A. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| B. | Mg-Al及NaOH溶液构成的原电池中负极材料为Mg | |
| C. | 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO | |
| D. | H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2- |
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
| A. | 精炼铜时粗铜做阴极,纯铜做阳极 | |
| B. | 电解MgCl2饱和溶液,可制得金属镁 | |
| C. | 钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为:Fe-3e-═Fe3+ | |
| D. | 氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是:2Cl--2e-═Cl2↑ |
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 用氯化铁溶液腐蚀铜板:Fe3++Cu═Cu2++Fe2+ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |

 +2CH3CH2OH$?_{△}^{浓硫酸}$
+2CH3CH2OH$?_{△}^{浓硫酸}$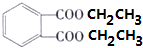 +2H2O
+2H2O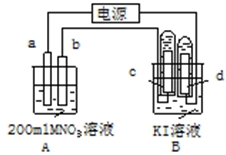 如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答
如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答