题目内容
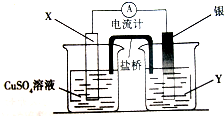
12.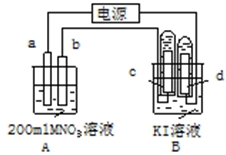 如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答
如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答(1)a连接电源的正极.b极的电极反应式为M++e-═M.
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:C电极周围先变蓝色,电解进行一段时间后,罩在C极上的试管中也收集到了气体.此时C极上的电极反应式为4OH--4e-=O2↑+2H2O
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了0.001mol气体,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为108g/mol.
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL.取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全.试计算电解前A烧杯中MNO3溶液的物质的量浓度为多少?
分析 (1)接通电源,金属M沉积于b极,同时a、d电极上产生气泡,则b为阴极,M离子在阴极放电生成金属单质,a为阳极与正极相连;
(2)B中I-在c极上放电,电解一段时间后,OH-也放电;
(3)根据串联电路中以及电解池中阴、阳两极得失电子数目相等求出气体的物质的量和金属的物质的量,最后根据M=$\frac{m}{n}$求出金属的摩尔质量;
(4)先根据(3)求出已放电的M+的物质的量,然后根据剩余的溶液与HCl反应求出剩余的M+,两者相加得原溶液中的M+,的物质的量,最后带入公式C=$\frac{n}{V}$,求出电解前A烧杯中MNO3溶液的物质的量浓度.
解答 解:(1)接通电源,金属M沉积于b极,同时a、d电极上产生气泡,则b为阴极,M离子在阴极放电生成金属单质,b电极的反应式为:M++e-═M,
故答案为:正;M++e-═M;
(2)B中I-在c极上放电生成碘单质,遇淀粉变蓝,则观察到c极附近溶液颜色变为蓝色,电解一段时间后,OH-也放电,电极反应为4OH--4e_=2H2O+O2↑,
故答案为:c电极周围先变蓝色;4OH--4e-=2H2O+O2↑;
(3)n(H2)=$\frac{0.0448L}{22.4L/mol}$=0.002mol,则转移电子为0.004mol,a电极反应为4OH--4e_=2H2O+O2↑,所以生成氧气为0.001mol,由H2~2e-~2M可知,则n(M)=0.004mol,所以金属的摩尔质量为$\frac{0.432g}{0.004mol}$=108g/mol,
故答案为:0.001;108g/mol;
(4)设稀释后溶液的浓度为X,根据反应:Cl-+M+=MCl↓
0.100 mol/L×0.025L X×0.025L
解得X=0.1mol•L-1
所以200mL电解停止后加蒸馏水稀释的溶液中,M+ 的物质的量为0.1mol•L-1×0.2L=0.02mol
则电解前A烧杯中MNO3溶液的M+ 物质的量=0.004mol+0.02mol=0.024mol
所以MNO3溶液的物质的量浓度=$\frac{0.024mol}{0.1L}$mol/L=0.12mol/L,
答:电解前A烧杯中MNO3溶液的物质的量浓度为0.12mol/L.
点评 本题考查电解原理,明确惰性电极电解时离子的放电顺序及发生的电极反应是解答本题的关键,注意转移的电子守恒来解答,题目难度中等,侧重于考查学生的分析能力和计算能力.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案CO(g)+2H2(g)?CH3OH(g)
①下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.

 全球气候变暖已经成为全世界人类面临的重大问题.
全球气候变暖已经成为全世界人类面临的重大问题.