题目内容
16.下列说法正确的是( )| A. | 精炼铜时粗铜做阴极,纯铜做阳极 | |
| B. | 电解MgCl2饱和溶液,可制得金属镁 | |
| C. | 钢铁的腐蚀通常为电化学腐蚀,该腐蚀过程中负极反应为:Fe-3e-═Fe3+ | |
| D. | 氯碱工业和金属钠的冶炼都用到了NaCl,阳极反应都是:2Cl--2e-═Cl2↑ |
分析 A.精炼铜时粗铜做阳极,纯铜为阴极;
B.电解氯化镁溶液生成氢氧化镁、氯气和氢气;
C.铁被氧化生成亚铁离子;
D.工业用电解熔融的氯化钠制备钠,用电解饱和食盐水制备氯气、氢气和氢氧化钠.
解答 解:A.精炼铜时粗铜做阳极,纯铜为阴极,如粗铜为阴极,则析出的铜不纯净,故A错误;
B.镁为活金属,电解氯化镁溶液生成氢氧化镁、氯气和氢气,工业用电解熔融的氯化镁冶炼镁,故B错误;
C.铁被氧化生成亚铁离子,应为Fe-2e-═Fe2+,故C错误;
D.工业用电解熔融的氯化钠制备钠,在阳极析出氯气,在阴极析出钠,用电解饱和食盐水制备氯气、氢气和氢氧化钠,阳极析出氯气,在阴极析出氢气和氢氧化钠,故D正确.
故选D.
点评 本题综合考查电解原理及应用,涉及粗铜的精炼、氯碱工业、金属的冶炼和电化学腐蚀等问题,有利于培养学生良好的科学素养,题目难度不大,注意把握电解原理.

练习册系列答案
相关题目
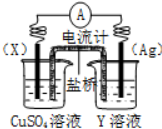
6.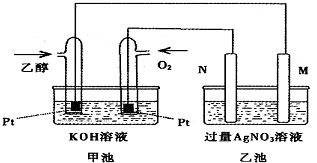 甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
 甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )| A. | M电极的材料是石墨 | |
| B. | 若乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气为224mL | |
| C. | 在此过程中,甲池中OH-向通乙醇的一极移动 | |
| D. | 在此过程中,乙池溶液中电子从M电极向N电极移动 |
5.下列离子方程式书写正确的是( )
| A. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| B. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| C. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向氯化铝溶液中加入足量氨水:A13++4NH3•H2O═AlO2-+2H2O+4NH4+ |
6.下列有关分子和原子的说法中,错误的是( )
| A. | 原子是由原子核和核外电子构成的 | |
| B. | 保持水的化学性质的粒子是水分子 | |
| C. | 分子的质量总比原子的质量大 | |
| D. | 在化学反应中分子可分而原子不可分 |
 全球气候变暖已经成为全世界人类面临的重大问题.
全球气候变暖已经成为全世界人类面临的重大问题.
 如图蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2
如图蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2