题目内容
15.下列各组离子在指定溶液中一定能大量共存的是( )| A. | 能使紫色石蕊试剂变红的溶液中:NO3-、I-、Ba2+、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| C. | pH=1的溶液中:K+、Br-、SO42-、Al3+ | |
| D. | 澄清石灰水中:Na+、K+、CH3COO-、HCO3- |
分析 A.能使紫色石蕊试剂变红的溶液呈酸性,酸性条件下硝酸根离子能够氧化碘离子、亚铁离子;
B.铁离子与硫氰根离子、碘离子;
C.pH=1的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
D.碳酸氢根离子与氢氧化钙反应.
解答 解:A.能使紫色石蕊试剂变红的溶液呈酸性,NO3-在酸性条件下具有强氧化性,能够氧化I-、Fe2+,在溶液中不能大量共存,故A错误;
B.Fe3+与SCN-、I-发生反应,在溶液中不能大量共存,故B错误;
C.pH=1的溶液呈酸性,溶液中存在大量氢离子,K+、Br-、SO42-、Al3+之间不反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.HCO3-与氢氧化钙反应,在原子不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
5.将氯气通入一定温度的氢氧化钾溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的溶液,测得该溶液中c(ClO-):c(ClO3-)=2:1,则溶液中KCl和KClO的物质的量之比为( )
| A. | 1:1 | B. | 2:5 | C. | 7:2 | D. | 2:7 |
3.下列电离方程式中,不正确的是( )
| A. | HCl═H++Cl- | B. | H2SO4═2H++SO42- | C. | FeCl3═Fe3++Cl- | D. | NaOH═Na++OH- |
10.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 在燃煤时加入适量石灰石,可减少 SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 | |
| B. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶液的 PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | |
| C. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2 +2H2O | |
| D. | 在盐碱地(含较多 NaCl、Na2CO3)上通过施加适量 CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4 |
20.一般情况下,胶体粒子不易聚集,表现较稳定,主要原因是因为( )
| A. | 胶体有丁达尔效应 | |
| B. | B、胶体粒子直径在1nm-100nm之间 | |
| C. | 胶体粒子很小,不受重力作用 | |
| D. | 同种胶体粒子带同种电荷,它们之间互相排斥 |
7.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、4、6、8,它们的最外层电子数之和为17.下列说法不正确的是( )
| A. | 阴离子的半径:Y>W | |
| B. | 气态氢化物稳定性:Y>Z | |
| C. | 最外层电子数:Y=Z | |
| D. | X、Y、Z中的两种元素形成的化合物在常温下都为气体 |
4.可逆反应A(s)+B(g)?2C(g)△H<0在密闭容器中达到平衡后,改变条件,能使B转化率提高的是( )
| A. | 保持温度不变,减小压强 | B. | 保持恒温恒容,充入氦气 | ||
| C. | 其它条件不变时,升高温度 | D. | 其它条件不变时,加入少量A |
5.如图是自然界中N、S两种元素的循环过程:根据图内容,判断下列说法正确的是( )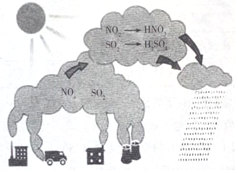

| A. | 图示过程表示了地球臭氧层的破坏过程 | |
| B. | 图中涉及的氧化物均为酸性氧化物 | |
| C. | 机动车尾气含有N的氧化产物 | |
| D. | 图示中描述的过程所涉及的反应均为氧化还原反应 |