题目内容
6.合金与各成分的金属相比,其特点为硬度比纯金属大(填“大”或“小”,下同),熔点比各成分金属低.分析 合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,合金的硬度大,熔点低.
解答 解:合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点 低于组成它的成分金属的熔点.
故答案为:大;低.
点评 本题考查合金的概念及其合金的性质,难度不大,注意基础知识的积累,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
9.已知:RCH2OH$\stackrel{K_{2}Cr_{2}O_{7}/H+}{→}$RCHO$\stackrel{K_{2}Cr_{2}O_{7}/H+}{→}$RCOOH某有机物 X 的化学式为 C5H12O,能和钠反应放出氢气.X 经酸性重铬酸钾(K2Cr2O7)溶液氧化最终生成Y (C5H10O2),若不考虑立体结构.X和Y在一定条件下生成酯最多有( )
| A. | 32 种 | B. | 24 种 | C. | 16 种 | D. | 8 种 |
17.一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
| A. | 过量的NaOH溶液与AlCl3溶液 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为2NA | |
| B. | 在反应KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3molCl2转移的电子数为6NA | |
| C. | 含4molSi-O键的二氧化硅晶体中,氧原子数为2NA | |
| D. | 某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO3分子数为0.2NA |
1.有机高分子合成材料的出现是材料发展史上的重大突破.下列物质中含有高分子合成材料的是( )
| A. | 不锈钢 | B. | 棉花 | C. | 蚕丝 | D. | 汽车轮胎 |
11.将一小块金属钠投入下列溶液中,既能产生气体又会出现白色沉淀的是( )
| A. | 稀硫酸 | B. | 硫酸铜溶液 | C. | 稀氢氧化钠溶液 | D. | 氯化镁溶液 |
18.下列说法正确的是( )
| A. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在101 kPa时,1 mol H2完全燃烧生成水蒸气,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ/mol | |
| C. | 热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol表示1个固态碳原子和1分子水蒸气反应吸热131.1kJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,在相同条件下,将含0.5 mol H2SO4的稀硫酸与含1 mol Ba(OH)2的水溶液混合,放出的热量可能大于57.3 kJ |
15.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使紫色石蕊试剂变红的溶液中:NO3-、I-、Ba2+、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| C. | pH=1的溶液中:K+、Br-、SO42-、Al3+ | |
| D. | 澄清石灰水中:Na+、K+、CH3COO-、HCO3- |
16.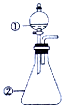 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠混合溶液 | 立即产生气泡 |
| B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
| D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |