题目内容
19.工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).(1)在一定温度和压强下,CO(g)+2H2(g)?CH3OH(g)△H=-128.8kJ/mol.若将10a mol CO和20a mol H2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为$\frac{3}{32{a}^{2}}$(用含a的代数式表示).
若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是正向移动(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度增大(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是BE(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1:2:1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡 时数 据 | 反应能量变化的绝对值(kJ) | a | b | c |
| 反应物转化率 | α1 | α2 | α3 | |
分析 (1)开始时c(CO)=$\frac{10amol}{2L}$=5amol/L、c(H2)=$\frac{20amol}{2L}$=10amol/L,反应的c(CO)=5amol/L×60%=3amol/L,
CO(g)+2H2(g)?CH3OH(g)△H=-128.8kJ/mol
开始(mol/L)5a 10a 0
反应(mol/L)3a 6a 3a
平衡(mol/L)2a 4a 3a
该反应的化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$;
此时c(CO)=2amol/L+$\frac{10amol}{2L}$=7amol/L、c(H2)=4amol/L+$\frac{20amol}{2L}$=14amol/L、c(CH3OH)=3amol/L+$\frac{10amol}{2L}$=8amol/L,浓度商=$\frac{8a}{7a×(14a)^{2}}$,根据浓度商与化学平衡常数相对大小确定反应方向;从而确定CO浓度变化;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(3)甲、乙是等效平衡,丙等效为在乙的基础上增大压强,
生成1molCH3OH的能量变化为128.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,计算反应热数值;
甲、乙处于相同的平衡状态,则α1+α2=1,比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动.
解答 解:(1)开始时c(CO)=$\frac{10amol}{2L}$=5amol/L、c(H2)=$\frac{20amol}{2L}$=10amol/L,反应的c(CO)=5amol/L×60%=3amol/L,
CO(g)+2H2(g)?CH3OH(g)△H=-128.8kJ/mol
开始(mol/L)5a 10a 0
反应(mol/L)3a 6a 3a
平衡(mol/L)2a 4a 3a
该反应的化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$=$\frac{3a}{2a×(4a)^{2}}$=$\frac{3}{32{a}^{2}}$;
此时c(CO)=2amol/L+$\frac{10amol}{2L}$=7amol/L、c(H2)=4amol/L+$\frac{20amol}{2L}$=14amol/L、c(CH3OH)=3amol/L+$\frac{10amol}{2L}$=8amol/L,浓度商=$\frac{8a}{7a×(14a)^{2}}$=$\frac{2}{343{a}^{2}}$<$\frac{3}{32{a}^{2}}$,所以平衡正向移动,但再次达到平衡浓度大于原来平衡浓度,
故答案为:$\frac{3}{32{a}^{2}}$;正向移动;增大;
(2)A.反应前后气体总质量不变、容器体积不变,所以混合气体的密度始终不变,不能据此判断平衡状态,故A错误;
B.反应前后气体的总质量不变但物质的量减小,所以反应前后混合气体的平均相对分子质量增大,当混合气体相对分子质量不变时,正逆反应速率相等,反应发达平衡状态,故B正确;
C.v逆(H2)=2v正(CO)时该反应达到平衡状态,所以2v逆(H2)=v正(CO)时没有达到平衡状态,故C错误;
D.容器内CO、H2、CH3OH的浓度之比为1:2:1时该反应不一定达到平衡状态,与反应初始浓度及转化率有关,故C错误;
E.CH3OH、CO、H2的浓度都不再发生变化时,正逆反应速率相等,反应达到平衡状态,故E正确;
故选BE;
(3)甲、乙是等效平衡,丙等效为在乙的基础上增大压强,
生成1molCH3OH的能量变化为128.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=128.8n,等于乙容器b=128.8(1-n),故a+b=128.8;
甲、乙处于相同的平衡状态,则α1+α2=1,比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动,所以α1+α3<1,
故答案为:128.8;<.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量关系及变化是解本题关键,注意“(1)第三问中平衡正向移动但加入的CO物质的量远远大于反应的CO物质的量,导致平衡时CO浓度增大“,注意(3)题等效平衡构建,为易错点及难点.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案| A. | 整个反应阶段平均速率:醋酸>盐酸 | B. | 反应所需时间:醋酸>盐酸 | ||
| C. | 参加反应的锌质量:盐酸>醋酸 | D. | 开始,反应速率:盐酸>醋酸 |
| A. | 铜、CaO、SO2 | B. | KCl、盐酸、NaOH | ||
| C. | CuSO4•5H2O、冰、乙醇 | D. | O3、CaCO3、空气 |
| A. | C3H7OH | B. | C2H4 | C. | C2H6O | D. | C3H6O2 |
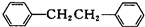 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: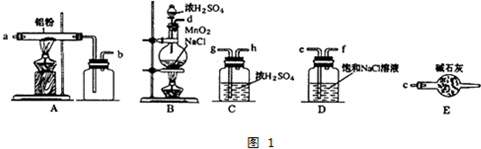

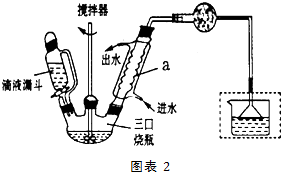
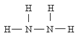 )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.