��Ŀ����
11����֪���ܱ������з�ӦA��g��+3B��g��?2C��g�� ��һ���¶��´ﵽƽ�⣬��1����ƽ��ʱ��ø����ʵ����ʵ����ֱ�Ϊn��A��=1.0mol��n��B��=0.4mol��n��C��=0.4mol����ʱ�������Ϊ2L����������µ�ƽ�ⳣ��K=10��
��2���������¶Ⱥ�ѹǿ���䣬�ڣ�1����ƽ����������������ͨ��0.36mol A ��g����ƽ�⽫��������������������ƶ����ü�Ҫ�ļ������˵�����ɺ��º�ѹ�£���������ʵ�������������ȣ�����0.36molAʱ���������=$\frac{��1.0+0.4+0.4+0.36��mol��2L}{��1.0+0.4+0.4��mol}$=2.4L����ʱ������Ũ�ȣ�c��A��=$\frac{��1.0+0.36��mol}{2.4L}$=$\frac{17}{30}$mol/L��c��B��=c��C��=$\frac{0.4}{2.4}$mol/L=$\frac{1}{6}$mol/L��Ũ����=$\frac{��\frac{1}{6}��^{2}}{\frac{17}{30}����\frac{1}{6}��^{3}}$=10.9��K��ƽ�������ƶ���
���� ��1����ʱ��c��A��=$\frac{1.0mol}{2L}$=0.5mol/L��c��B��=$\frac{0.4mol}{2L}$=0.2mol/L��c��C��=$\frac{0.4mol}{2L}$=0.2mol/L��
��ѧƽ�ⳣ��K=$\frac{{c}^{2}��C��}{c��A����{c}^{3}��B��}$��
��2�����º�ѹ�£���������ʵ�������������ȣ�����0.36molAʱ���������=$\frac{��1.0+0.4+0.4+0.36��mol��2L}{��1.0+0.4+0.4��mol}$=2.4L����ʱ������Ũ�ȣ�c��A��=$\frac{��1.0+0.36��mol}{2.4L}$=$\frac{17}{30}$mol/L��c��B��=c��C��=$\frac{0.4}{2.4}$mol/L=$\frac{1}{6}$mol/L����Ũ�����뻯ѧƽ�ⳣ����Դ�С�ж�ƽ���ƶ�����
��� �⣺��1����ʱ��c��A��=$\frac{1.0mol}{2L}$=0.5mol/L��c��B��=$\frac{0.4mol}{2L}$=0.2mol/L��c��C��=$\frac{0.4mol}{2L}$=0.2mol/L��
��ѧƽ�ⳣ��K=$\frac{{c}^{2}��C��}{c��A����{c}^{3}��B��}$=$\frac{��0��{2��}^{2}}{0.5����0.2��^{3}}$=10��
�ʴ�Ϊ��10��
��2�����º�ѹ�£���������ʵ�������������ȣ�����0.36molAʱ���������=$\frac{��1.0+0.4+0.4+0.36��mol��2L}{��1.0+0.4+0.4��mol}$=2.4L����ʱ������Ũ�ȣ�c��A��=$\frac{��1.0+0.36��mol}{2.4L}$=$\frac{17}{30}$mol/L��c��B��=c��C��=$\frac{0.4}{2.4}$mol/L=$\frac{1}{6}$mol/L��Ũ����=$\frac{��\frac{1}{6}��^{2}}{\frac{17}{30}����\frac{1}{6}��^{3}}$=10.9��K��ƽ�������ƶ���
�ʴ�Ϊ�������º�ѹ�£���������ʵ�������������ȣ�����0.36molAʱ���������=$\frac{��1.0+0.4+0.4+0.36��mol��2L}{��1.0+0.4+0.4��mol}$=2.4L����ʱ������Ũ�ȣ�c��A��=$\frac{��1.0+0.36��mol}{2.4L}$=$\frac{17}{30}$mol/L��c��B��=c��C��=$\frac{0.4}{2.4}$mol/L=$\frac{1}{6}$mol/L��Ũ����=$\frac{��\frac{1}{6}��^{2}}{\frac{17}{30}����\frac{1}{6}��^{3}}$=10.9��K��ƽ�������ƶ���
���� ���⿼�黯ѧƽ����㣬Ϊ��Ƶ���㣬���ؿ���ѧ�������������������á�����ʽ����������⣬ע�⣨2����Ҫ����Ũ�����뻯ѧƽ�ⳣ����Դ�С�ж�ƽ���ƶ����ܶ�ͬѧ�������ԡ���������ı䡱����ΪAŨ������ƽ�������ƶ���Ϊ�״��㣮

 ��У����ϵ�д�
��У����ϵ�д�Cl+Cl��Cl2��H1=-243kJ/mol��
O+O��O2��H2=-497kJ/mol��
N+N��N2��H3=-946kJ/mol��
����Եó��Ľ����ǣ�������
| A�� | �ڳ����µ����������������ȶ� | |
| B�� | ���������ȵĵ��ʳ�����Ϊ���� | |
| C�� | ���������ȷ����ڷ�Ӧ�������ͷ����� | |
| D�� | �������������������ܶȲ�ͬ |
�ٶ���������±������ ���ں����뺣�����γ�ɳ�� ����ˮ��ϻ�ֲ�ܹ������þ������ ��CuSO4��NaOH��Һ��ϲ������� ��ѪҺ����
| A�� | �٢ڢܢ� | B�� | �٢ڢۢ� | C�� | �ۢܢݢ� | D�� | ȫ�� |
��1����һ���¶Ⱥ�ѹǿ�£�CO��g��+2H2��g��?CH3OH��g����H=-128.8kJ/mol������10a mol CO��20a mol H2����2L���ܱ������У���ַ�Ӧ����CO��ת����Ϊ60%����÷�Ӧ��ƽ�ⳣ��Ϊ$\frac{3}{32{a}^{2}}$���ú�a�Ĵ���ʽ��ʾ����
����ʱ�����������Ͷ��10a mol CO��20a mol H2��10a mol CH3OH��g�����ж�ƽ���ƶ��ķ����������ƶ���������ƶ������������ƶ������ƶ�������
��ԭƽ����ȣ�CO�����ʵ���Ũ����������������䡱��С������
��2���жϸ÷�Ӧ�ﵽƽ��״̬��������BE������ĸ��ţ���
A�����������ܶȲ���
B����������ƽ����Է�����������
C��2v����H2��=v����CO��
D��������CO��H2��CH3OH��Ũ��֮��Ϊ1��2��1
E��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��3��һ�������£����ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1 mol CO�� 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| ƽ�� ʱ�� �� | ��Ӧ�����仯�ľ���ֵ��kJ�� | a | b | c |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
| A�� | ̿ȼ������һ����̼ | B�� | Ba��OH��2•8H2O��NH4Cl��Ӧ | ||
| C�� | п����ϡ���ᷴӦ��ȡH2 | D�� | �кͷ�Ӧ |
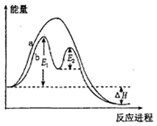
| A�� | ��Ӧ����a�д������� | |
| B�� | �÷�ӦΪ���ȷ�Ӧ | |
| C�� | �ı�������ɸı�÷�Ӧ�Ļ�� | |
| D�� | �д��������£���Ӧ�Ļ�ܵ���E1+E2 |
