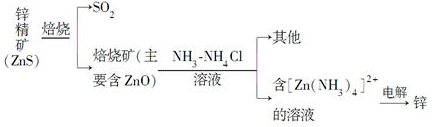
题目内容
8.肼(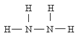 )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(2)已知:①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol
(3)已知断裂1mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N-N为154、H-O为464、请根据N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1中数据计算断裂1molN-H键所需的能量(kJ)是:403
(4)写出NH3与NaClO反应得到肼的化学方程式:2NH3+NaClO=N2H4+NaCl+H2O.
分析 (1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)依据盖斯定律:②×2-①得到:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g),反应热与化学计量数成正比;
(3)反应中焓变等于反应物中键能之和-生成物中键能之和;
(4)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,同时生成氯化钠与水.
解答 解:(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
(3)设断裂1molN-H键所需的能量为x,
由反应及焓变等于反应物中键能之和-生成物中键能之和可知,
4x+154+498-942-2×2×464=-534,
解得x=403(kJ),
故答案为:403;
(4)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O.
点评 本题考查了氧化还原反应、盖斯定律的应用、燃料电池中电极反应式书写等知识,题目难度中等.

| A. | 组成元素相同,各元素质量分数也相同的不同物质属于同系物 | |
| B. | 分子式相同的不同物质一定是同分异构体 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 通式相同的不同物质一定属于同系物 |
(1)在一定温度和压强下,CO(g)+2H2(g)?CH3OH(g)△H=-128.8kJ/mol.若将10a mol CO和20a mol H2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为$\frac{3}{32{a}^{2}}$(用含a的代数式表示).
若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是正向移动(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度增大(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是BE(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1:2:1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡 时数 据 | 反应能量变化的绝对值(kJ) | a | b | c |
| 反应物转化率 | α1 | α2 | α3 | |
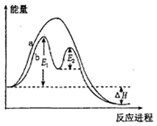
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为吸热反应 | |
| C. | 改变催化剂,可改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
| A. | υ(H2)=0.1 mol•L-1•min-1 | B. | υ(N2)=0.2 mol•L-1•min-1 | ||
| C. | υ(NH3)=0.15 mol•L-1•min-1 | D. | υ(H2)=0.3 mol•L-1•min-1 |