题目内容
6.下列反应一定属于放热反应的是( )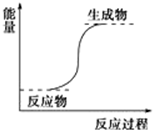
| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. | 能量变化如图所示的反应 | |
| C. | 化学键断裂吸收的能量比化学键形成放出的能量少的反应 | |
| D. | 不需要加热就能发生的反应 |
分析 放热反应还是反应物的总能量大于生成物的总能量的反应,或是断键吸收的能量小于成键放出的能量的反应,常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
吸热反应时反应物的总能量小于生成物的总能量的反应,或是断键吸收的能量大于成键放出的能量的反应,常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),据此分析.
解答 解:A、铵盐和碱的反应为吸热反应,故A错误;
B、根据图示可知,反应物的总能量小于生成物的总能量,故反应吸热,故B错误;
C、断键吸收的能量小于成键放出的能量的反应为放热反应,故C正确;.
D、反应吸放热与反应是否需要加热无关,即需要加热的反应不一定是吸热反应,不需要加热的反应不一定是放热反应,故D错误.
故选C
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
相关题目
1.现有含FeCl2杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:

25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
请回答下列问题:
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2C.Cu(OH)2D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).理由:加热促进铜离子水解,生成的HCl易挥发,则不能直接蒸发结晶得到CuCl2•2H2O.

25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
(1)流程中加入的试剂a最合适的是C(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是将Fe2+氧化.
(2)调节pH约4应该加入的物质可以是AC.
A.CuO B.CuCl2C.Cu(OH)2D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl2•2H2O?不能(填“能”或“不能”).理由:加热促进铜离子水解,生成的HCl易挥发,则不能直接蒸发结晶得到CuCl2•2H2O.
18.下列有关物质性质的应用正确的是( )
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 二氧化硫具有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 浓硫酸具有吸水性,可以用来干燥氨气 | |
| D. | 次氯酸钠具有强氧化性,可用于配制消毒液 |
15.已知下列热化学反应方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJ•mol-1.
则FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式为( )
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJ•mol-1.
则FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式为( )
| A. | FeO+CO═Fe+CO2 △H=-11kJ•mol-1 | |
| B. | FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-22kJ•mol-1 | |
| C. | FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ•mol-1 | |
| D. | FeO(s)+CO(g)═Fe(s)+CO2(g))△H=11kJ•mol-1 |