题目内容
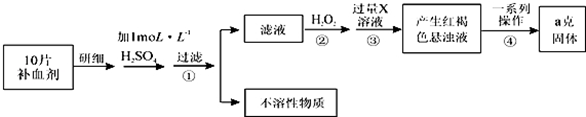
14.工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿,软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分,闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分.I.(1)为了测量软锰矿中MnO2含量的测定,现将14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0.1000mol•L-1的标准Na2S2O3溶液滴定,消耗标准液50.00ml,则软锰矿中MnO2含量60%.(已知:2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4; I2+2S2O32-=2I-+S4O62-)
Ⅱ.研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图1所示.

请回答下列问题:
(2)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等.试完成反应I中生成CuSO4和MnSO4的化学方程MnO2+CuS+2H2SO4=S+2H2O+CuSO4+MnSO4.
(3)反应Ⅱ加入适量锌的作用是将溶液中的硫酸铜转化为铜;如果锌过量,还会进一步发生反应的离子方程式为Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+.
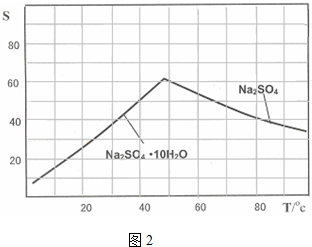
(4)图2是Na2SO4和Na2SO4•10H2O的溶解度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→趁热过滤→用乙醇洗涤→干燥.用乙醇洗涤而不用水洗的原因是防止Na2SO4固体因溶解而减少,防止Na2SO4固体转变为Na2SO4•10H2O晶体.
(5)用惰性电极电解MnSO4和ZnSO4制得Zn和MnO2的总反应是:MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$Zn+MnO2+2H2SO4.
(6)本工艺可以循环利用的物质除MnO2、MnCO3、ZnCO3以外,还有Zn(写化学式).
分析 (1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32-=2I-+S4O62-,MnO2~I2~2S2O32-,依据离子方程式定量关系计算,注意溶液体积的变化;
(2)生成CuSO4和MnSO4的化学方程式是MnO2,CuS在酸性溶液中发生的氧化还原反应,氧化剂为MnO2,被还原为硫酸锰,还原剂为CuS,被氧化为硫单质同时生成硫酸铜,依据电子守恒和原子守恒写出化学方程式判断;
(3)流程图分析,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会和亚铁离子反应生成铁单质;
(4)依据图象的溶解度随温度变化分析判断,得到硫酸钠的适宜条件,注意溶解度的影响;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极失电子生成,据此书写化学方程式;
(6)可以循环利用的物质是反应过程中重复使用,最后又生成可以进行循环使用.
解答 解:(1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32-=2I-+S4O62-,
MnO2~I2~2S2O32-,
1 2
n 0.1000mol•L-1×0.050L
n=0.0025mol
1L溶液中含MnO2物质的量=0.0025mol×$\frac{1000}{25}$=0.1mol,
则软锰矿中MnO2含量=$\frac{0.1mol×87g/mol}{14.5g}$×100%=60%,
故答案为:60%;
(2)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4和MnSO4硫单质,反应的化学方程式为:MnO2+CuS+2H2SO4=S↓+CuSO4+MnSO4+2H2O,
故答案为:2H2SO4;S;2H2O;
(3)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会继续反应置换出铁;反应的离子方程式为:Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+,
故答案为:将溶液中的硫酸铜转化为铜;Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+;
(4)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,
故答案为:趁热过滤,防止Na2SO4固体因溶解而减少,防止Na2SO4固体转变为Na2SO4•10H2O晶体;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出,电极反应为:Zn2++2e-=Zn;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,反应的化学方程式为:MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$Zn+MnO2+2H2SO4,
故答案为:MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$Zn+MnO2+2H2SO4;
(6)依据流程图可知能循环使用的物质为Zn、ZnCO3、MnCO3和MnO2,
故答案为:Zn.
点评 本题考查了物质制备实验的分析判断,物质溶解性的理解应用,电解原理的应用判断,电极反应的产物判断和电极反应书写,题目难度较大.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 | |
| B. | 原子半径:X<Y | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |
| A. | Na+、Cu2+、NO3-、CO32- | B. | Ba2+、K+、Cl-、HCO3- | ||
| C. | Fe2+、Na+、SO42-、NO3- | D. | Mg2+、NH4+、SO42-、Cl- |
| A. | 用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏大 | |
| B. | 蒸馏时,应使温度计水银球放在蒸馏烧瓶的支管口处 | |
| C. | 盛放NaOH溶液时,可以使用带玻璃瓶塞的磨口瓶 | |
| D. | .用广泛pH试纸测得0.10 mol•L-1 NH4Cl溶液的pH为5.2 |

| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. | 能量变化如图所示的反应 | |
| C. | 化学键断裂吸收的能量比化学键形成放出的能量少的反应 | |
| D. | 不需要加热就能发生的反应 |
 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属. (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是AD.
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是AD.