题目内容
17.钠的密度为0.97g•cm-3,水的密度为1g•cm-3.将一块钠投入水中,反应过程中,钠熔化成一个闪亮的小球.某同学观察到闪亮小球与水面的相对位置为( )| A. |  | B. |  | C. |  | D. |  |
分析 根据钠比水的密度略小,钠与水接触的下部有无数小的氢气气泡,相当于在钠的下方加了无数小气垫,使钠上浮较多,而钠又不可能全部露出水面;
解答 解:按常规思考,根据钠比水的密度略小的事实,A好象是正确的,但由于与水接触的钠的下部有无数小的氢气气泡,相当于在钠的下方加了无数小气垫,使钠上浮较多,而钠又不可能全部露出水面,因此,C应该是合理的
故选C.
点评 本题考查了钠的物物理性质、化学性质分析判断,主要是密度大小和与水反应生成气体的特征,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
7.下列物质属于纯净物的是( )
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
| A. | ①③⑤⑥ | B. | ③⑤⑥ | C. | ②④⑦ | D. | ③⑤ |
8.下列离子方程式书写正确的是( )
| A. | 在100ml 1mol•L-1的Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100ml 2mol•L-1的FeI2的溶液中通入标况下5.6L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入过量的NaOH溶液:Al3++4OH-═AlO2-+2H2O |
5.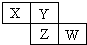 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 | |
| B. | 原子半径:X<Y | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |
12.已知混合粉末25g,与足量盐酸充分反应后,得到标况下的H2 11.2L,则下列各组金属可能是( )
| A. | Mg和Zn | B. | Zn和Fe、C | C. | Cu和Fe | D. | Zn和Cu |
9.下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀.该组离子可能是( )
| A. | Na+、Cu2+、NO3-、CO32- | B. | Ba2+、K+、Cl-、HCO3- | ||
| C. | Fe2+、Na+、SO42-、NO3- | D. | Mg2+、NH4+、SO42-、Cl- |
6.下列反应一定属于放热反应的是( )
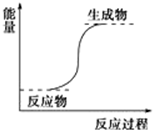

| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. | 能量变化如图所示的反应 | |
| C. | 化学键断裂吸收的能量比化学键形成放出的能量少的反应 | |
| D. | 不需要加热就能发生的反应 |
11.常温下,下列各组微粒在指定的溶液中一定能大量共存的是( )
| A. | 加入金属镁产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| B. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| C. | c(Cu2+)=0.1 mol•L-1的溶液中:H+、NH4+、Br-、CO32- | |
| D. | 含有大量MnO4-的溶液中:H+、SO42-、Cl-、CH3CH2OH |