题目内容
11.铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法.实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换.交换完成后,流出溶液的OH-用0.40mol•L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL.计算该样品中氯的物质的量,并求出FeClx中x的值:3(列出计算过程).
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为10%.在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
分析 (1)由离子交换关系,氢氧根离子物质的量等于氯离子物质的量等于氢离子物质的量,据此计算0.54g FeClx中氯离子物质的量计算x值;
(2)根据元素守恒计算氯化亚铁和氯化铁物质的量之比,进而计算氯化铁质量分数;氯化亚铁用铁和稀盐酸反应生成,氯化铁可以直接用铁和氯气反应得到.
解答 解:(1)n(Cl-)=n(H+)=n(OH-)=0.0250L×0.40 mol•L-1=0.010 mol,则$\frac{0.54g}{(56+35.5x)g/mol}$=0.010 mol,解得x=3,
故答案为:3;
(2)设混合物中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=$\frac{1}{1+9}$×100%=10%;
在实验室中,FeCl2可用铁粉和盐酸反应得到,FeCl3可用铁粉和氯气反应生成,
故答案为:10%;盐酸;氯气.
点评 本题考查滴定计算、混合物计算等,是对学生综合能力的考查,需要学生具备扎实的基础,(1)注意利用电荷守恒解答,难度中等.

练习册系列答案
相关题目
19.下列叙述正确的是( )
| A. | 用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏大 | |
| B. | 蒸馏时,应使温度计水银球放在蒸馏烧瓶的支管口处 | |
| C. | 盛放NaOH溶液时,可以使用带玻璃瓶塞的磨口瓶 | |
| D. | .用广泛pH试纸测得0.10 mol•L-1 NH4Cl溶液的pH为5.2 |
6.下列反应一定属于放热反应的是( )

| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
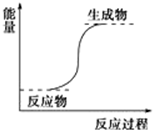
| B. | 能量变化如图所示的反应 | |
| C. | 化学键断裂吸收的能量比化学键形成放出的能量少的反应 | |
| D. | 不需要加热就能发生的反应 |
4.下列过程一定吸收热量的是( )
| A. | 化学反应过程中形成新的化学键 | B. | 干冰升华 | ||
| C. | 加热才能发生的化学反应 | D. | 氧化钙与水反应 |
5.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )

| A. | ZY、ZW 的水溶液都显酸性 | |
| B. | 原子半径大小:W>R>X,离子半径大小:Z+>R2->W->Y- | |
| C. | W 的氢化物水溶液的酸性比 R 的氢化物水溶液的酸性强,可证明非金属性:W>R | |
| D. | Z、X 两种元素可形成的 Z2X、Z2X2等多种离子化合物 |
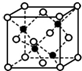 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.